新冠疫情:434万!美国FDA授予Moderna公司疫苗产品mRNA |
 |
2020年05月13日讯 /BIOON/ --新冠肺炎疫情正在全球迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时报告》,截止2020年05月13日11时,全球累计确诊超过434万例,国外累计确诊超过425万例、死亡超过28.8万例。美国累计确诊293万例,死亡8.3万例。
疫苗被认为是对抗新冠肺炎的终极武器。目前,已有相当多的企业投身疫苗研发领域,而Moderna被认为是其中最有潜力的企业之一,这是一家临床阶段的美国生物技术公司,开创了信使RNA(mRNA)疗法和疫苗,致力于为患者创造下一代变革性疗法。
近日,Moderna公司在研mRNA疫苗(mRNA-1273)迎来了一个重大喜讯。美国食品和药物管理局()已授予这款疫苗产品快速通道资格(FTD),该疫苗针对导致COVID-19的病毒,即新型冠状病毒(SARS-CoV-2)。值得一提的是,这也是Moderna公司获得的第4个FTD。此前,该公司寨卡病毒疫苗(mRNA-1893)、甲基丙二酸血症(MMA;mRNA-3704)、丙酸血症(PA;mRNA-3927)项目也获得了FTD资格认定。
快速通道资格(FTD)旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的医疗需求。研究性药物获得快速通道资格,意味着药企在研发阶段可以与进行更频繁的互动,在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,此外也有资格进行滚动审查。
Moderna公司首席医疗官Tal Zaks博士表示:“快速通道资格认定,体现了对对新型冠状病毒疫苗的迫切需求。在等待美国国家过敏与感染疾病研究所(NIAID)领导的I期研究的的全套临床数据之际,我们正积极准备II期和III期临床研究,以继续了解mRNA-1273对SARS-CoV-2的保护潜力。”
5月6日,美国已完成了对该公司mRNA-1273的试验性新药(IND)申请的审查,允许其进行II期研究,预计不久将开始。Moderna正在最后确定III期研究的方案,预计将于2020年初夏开始。
美国卫生和公众服务部(HHS)下属生物医学高级研究和发展局(BARDA)将为这些研究的规划提供支持,也将支持后期临床开发项目以及Moderna公司及战略合作伙伴龙沙(Lonza)生产工厂关于mRNA-1273制造规模的扩大升级。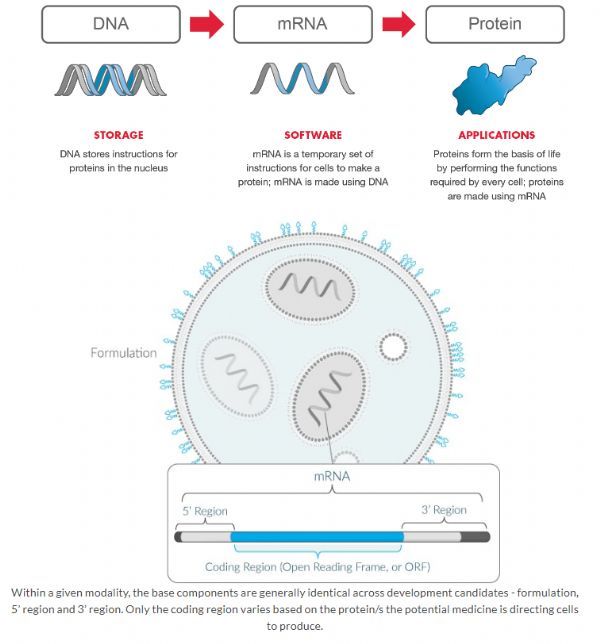
mRNA技术是近年来兴起的新一代疫苗技术,可对流行病疫情作出快速反应。mRNA方法用于预防性疫苗的潜在优势包括能够将多个mRNA组合成一个疫苗、快速发现以应对新出现的大流行威胁、从mRNA疫苗设计和生产的平台性质中获得的制造敏捷性。Moderna已经建立了一个完全集成的制造工厂,使技术平台的前景实现成为可能。
临床数据表明,Moderna的专利mRNA疫苗技术具有良好的耐受性,能够引起针对病毒抗原的持久免疫反应。
mRNA-1273是一种抗SARS-CoV-2的mRNA疫苗,可编码病毒刺突蛋白(S蛋白)的一种融合前稳定形式。mRNA-1273针对S蛋白发挥作用,该蛋白是病毒感染宿主细胞的关键所在,也是过去研发严重急性呼吸综合征(SARS)冠状病毒疫苗和中东呼吸综合征(MERS)冠状病毒疫苗时的靶点。 值得一提的是,mRNA-1273从序列选择到I期临床免疫注射仅仅花费了63天时间,首个临床批次于2月7日完成,首个受试者于3月16日完成注射免疫。
本月初,Moderna与龙沙(Lonza)签订了一项长达10年的战略合作协议,以实现大规模生产mRNA-1273以及Moderna其他未来的产品。(100医药网100yiyao.com)
原文出处:Moderna Receives Fast Track Designation for mRNA Vaccine (mRNA-1273) Against Novel Coronavirus
医药网新闻
- 相关报道
-
- 《自然·医学》:世卫组织最新预警!全球08-17年出生的人,或有1560万会患胃癌,76%归因与幽门螺杆菌感染,2/3发生在亚洲 (2025-07-09)
- 精鼎医药宣布两位 FDA 权威专家加入我司咨询团队,进一步增强监管事务、医学及 AI 领域专业实力 (2025-07-08)
- Mater Today Bio:干细胞球联手纳米颗粒水凝胶精准改善糖尿病创面环境,加速伤口愈合新突破 (2025-07-08)
- J Anim Sci Biotechnol研究揭秘美味密码:益生菌联手重塑肠道菌群,经肠-肌轴提升猪肉鲜味与品质 (2025-07-08)
- Science:告别序列依赖,为你的染色体“扫码”——每条染色体竟自带独一无二的“条形码 (2025-07-07)
- 《自然》子刊:刷新认知!哈佛团队发现,乙肝病毒自身或不致肝癌,但会增强致癌物的作用 (2025-07-07)
- 《科学》子刊:科学家揭示帕金森病中不同的发病轨迹,或为定义亚型和治疗靶点提供新见解! (2025-07-07)
- 《细胞》破解常见痴呆的治疗难题!“老药新用”有望恢复大脑功能 (2025-07-07)
- 华人学者本周发表4篇Cell论文:高度血管化的肺/肠道类器官;修复血管性痴呆;自身免疫病新疗法;同义突变调控性状 (2025-07-07)
- 内蒙古安迪科同位素诊疗药物生产中心举行奠基仪式 (2025-07-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















