《胃肠病学》:中国科学家破解肝癌对仑伐替尼耐药之谜,并发现肝癌治疗新靶点! |
 |
来源:奇点糕 2023-03-13 12:04
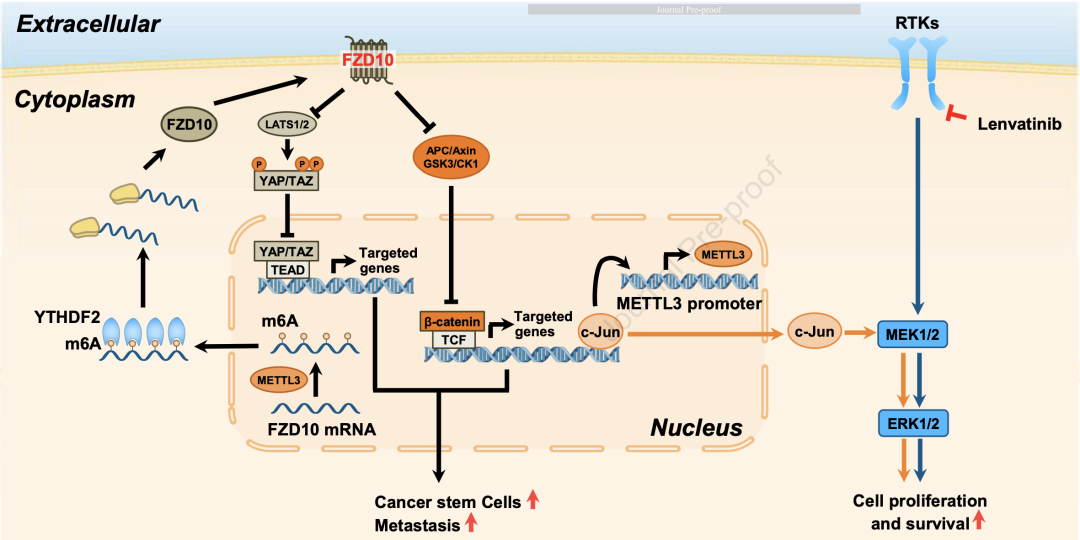
本研究发现在肝癌CSCs中高表达的FZD10一方面可以通过激活β-catenin和YAP1促进肝脏CSCs的自我更新、肿瘤发生和转移,另一方面可以通过c-Jun/MEK/ERK通路导致肝癌细胞对仑伐替肝细胞癌(HCC)是世界上第六大常见恶性肿瘤,也是癌症相关死亡的第四大主要原因[1]。
中国患者中,HBV感染患者和中晚期患者占比较高,患者预后差,5年生存率仅12.1%。虽然仑伐替尼已被批准用于晚期HCC的一线治疗,但大多数HCC患者在接受治疗后几个月内仍会出现病情进展。
总体而言,耐药是目前HCC相关死亡的主要原因之一,但对其背后的机制仍知之甚少。
近日,同济大学医学院附属东方医院、海军军医大学第三附属医院和上海长海医院的研究人员,在胃肠疾病领域权威期刊Gastroenterology发表了最新研究成果[2]。
在该研究中,他们发现FZD10在肝癌肿瘤(CSCs)中表达上调,并在肝癌细胞自我更新、致瘤性、转移和仑伐替尼耐药中发挥重要作用,提示FZD10是一种新的肝CSCs生物标志物,有望成为对仑伐替尼耐药HCC治疗的潜在靶点。

论文首页截图
CSCs是具有长期致瘤能力的肿瘤细胞的一个小亚群,是肿瘤内具有持续分裂、分化能力的一群细胞。通常这类的细胞被认为有形成肿瘤,发展成癌症的潜力,在癌症的发展和治疗耐药性中起着关键作用。在HCC患者中,大量CSCs的存在预示着较差的临床结果。然而,肝脏CSCs增殖的潜在机制仍不清楚。
因此,研究人员首先利用转录组学分析筛选出了可能与HCC中CSCs特性相关的潜在靶点,在所有上调的379个基因中,FZD10是上调倍数最多的,而且其表达水平与肝脏CSCs标记物EpCAM和CD24呈正相关。随着连续传代,FZD10的表达水平在原发性HCC球形细胞中逐渐升高。
考虑到肝CSCs与HCC复发、转移和化疗耐药密切相关,研究人员比较了FZD10在复发、转移和化疗耐药HCC组织中的表达。结果发现与原发病灶相比,FZD10在复发HCC、HCC转移灶中的表达显著上调。此外,仑伐替尼耐药HCC患者组织中FZD10的表达明显高于仑伐替尼敏感HCC患者组织。
总的来说,上述结果表明肝癌干细胞中FZD10表达上调,预示HCC患者预后不良。
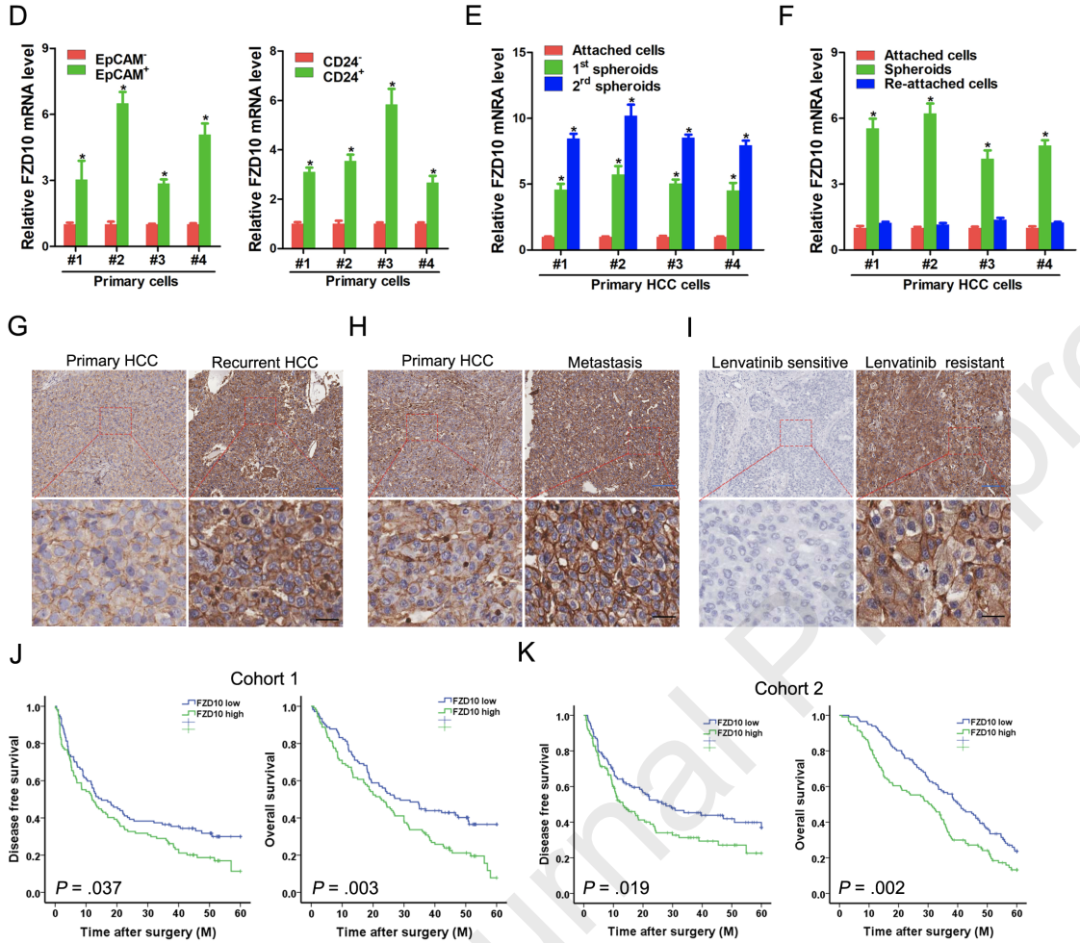
FZD10在肝脏CSCs中表达上调,预示着HCC预后不良
为了研究FZD10的临床意义,研究人员进一步分析了HCC患者FZD10的表达情况。相关回归分析显示,HCC组织中FZD10的高表达与侵袭性临床特征相关。Kaplan-Meier生存分析显示,HCC中FZD10的高表达与较短的无病生存期和总生存期相关。
随后,研究人员使用敲低、过表达实验探究了FZD10在肝脏CSCs中的潜在作用。结果发现FZD10敲低后,HCC的多能转录因子表达减少、球体形成受损、肝脏CSCs比例降低;相反,FZD10过表达则增加了HCC多能转录因子的数量、增强了HCC球体的形成能力、导致HCC细胞中CSCs比例增加,说明FZD10促进了肝脏CSCs的扩增。
此外,他们还注意到敲低FZD10削弱了HCC细胞的迁移和侵袭能力、显著降低肿瘤发生率,而FZD10的过表达则增强了细胞的迁移和侵袭能力,增加了肿瘤发病率,在小鼠中形成了更多的肺转移病灶。
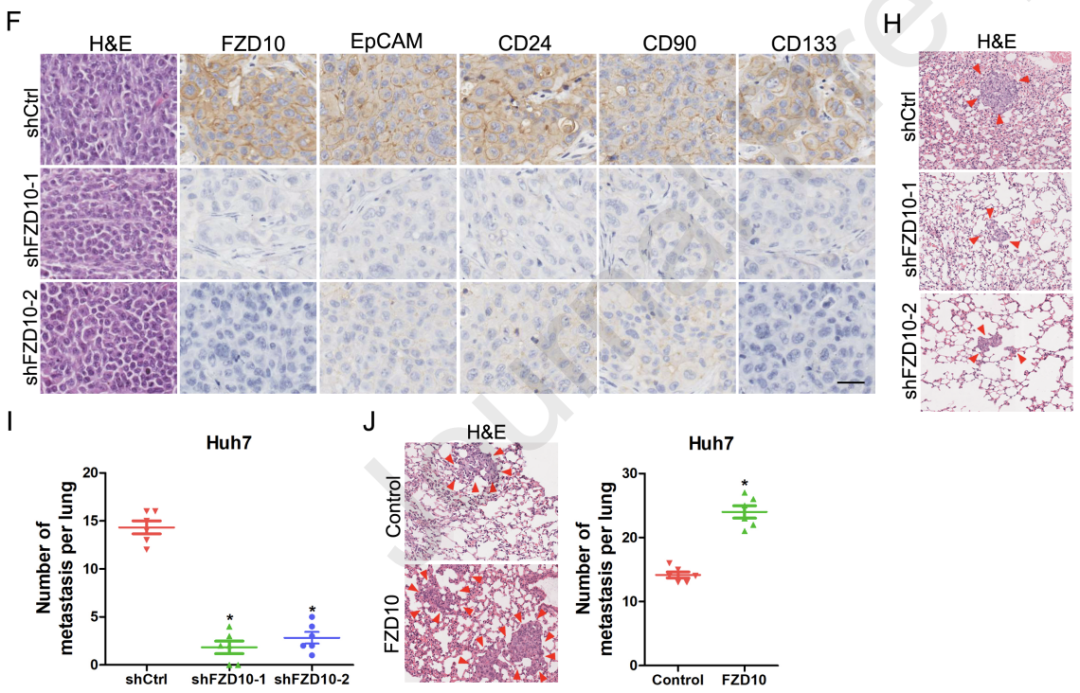
FZD10促进肝脏CSCs的扩增
为了阐明FZD10促进肝脏CSCs扩增的机制,研究人员使用RNA测序分析了FZD10过表达的HCC细胞中的基因表达情况。
KEGG信号通路富集分析显示,在过表达FZD10的HCC细胞中,MAPK、WNT/ -catenin和Hippo是前三大富集信号通路。鉴于已有研究报道WNT/ -catenin/TCF和Hippo信号通路在调控CSCs扩增中发挥重要作用,因此研究人员重点着眼于FZD10对WNT/ -catenin和Hippo信号通路的调控。
研究结果显示,FZD10敲除的HCC细胞中 -catenin的转录活性明显下调,核 -catenin的水平及其下游靶基因的表达均显著降低;而在FZD10过表达的HCC细胞中 -catenin的转录活性上调,核 -catenin的水平及其下游靶基因的表达明显增加。与之类似,过表达FZD10的HCC中YAP1核易位和靶基因表达上调,而FZD10敲除则观察到相反的结果。
此外,HCC患者的数据也进一步佐证了上述结果。在HCC患者中,FZD10的表达水平与核 -catenin和YAP1的水平呈正相关, -catenin、YAP1高表达对应肝癌患者较短的生存期。
因此,上述实验结果表明,在肝癌患者肿瘤干细胞中高表达的FZD10通过WNT/ -catenin和Hippo通路增强了肝脏CSCs的特性,促进了肝脏CSCs的自我更新,最终导致肿瘤的发生和转移。
越来越多的证据表明,肝脏CSCs与耐药性密切相关[3],基于上述研究结果,研究人员自然而然地想到,既然HCC中高表达的FZD10可以促进肝脏CSCs的特性,它是否也与肝癌患者对仑伐替尼的治疗耐受相关呢?
Kaplan-Meier分析显示,FZD10低表达的HCC患者在仑伐替尼治疗后存活时间更长,而FZD10高表达的患者对仑伐替尼治疗表现出较强的耐药性。与之相对应,FZD10过表达导致肝癌细胞抵抗仑伐替尼诱导的生长抑制和细胞凋亡。
进一步,研究人员利用患者源性肿瘤类器官(PDOs)和患者源性异种移植(PDXs)模型,验证了FZD10表达水平与仑伐替尼耐药性之间的相关性。结果发现FZD10表达水平较高的原发性HCC衍生的PDOs对仑伐替尼治疗具有耐药性,而FZD10表达水平较低的原发性HCC衍生的PDXs对仑伐替尼治疗极为敏感,仑伐替尼可以几乎完全阻断FZD10表达水平较低的PDXs的生长。
上述结果表明,FZD10低表达的HCC患者可能对仑伐替尼的治疗更为敏感,提示肝癌患者肿瘤中的FZD10水平,可以作为推断其对仑伐替尼反应性的可靠预测因子。
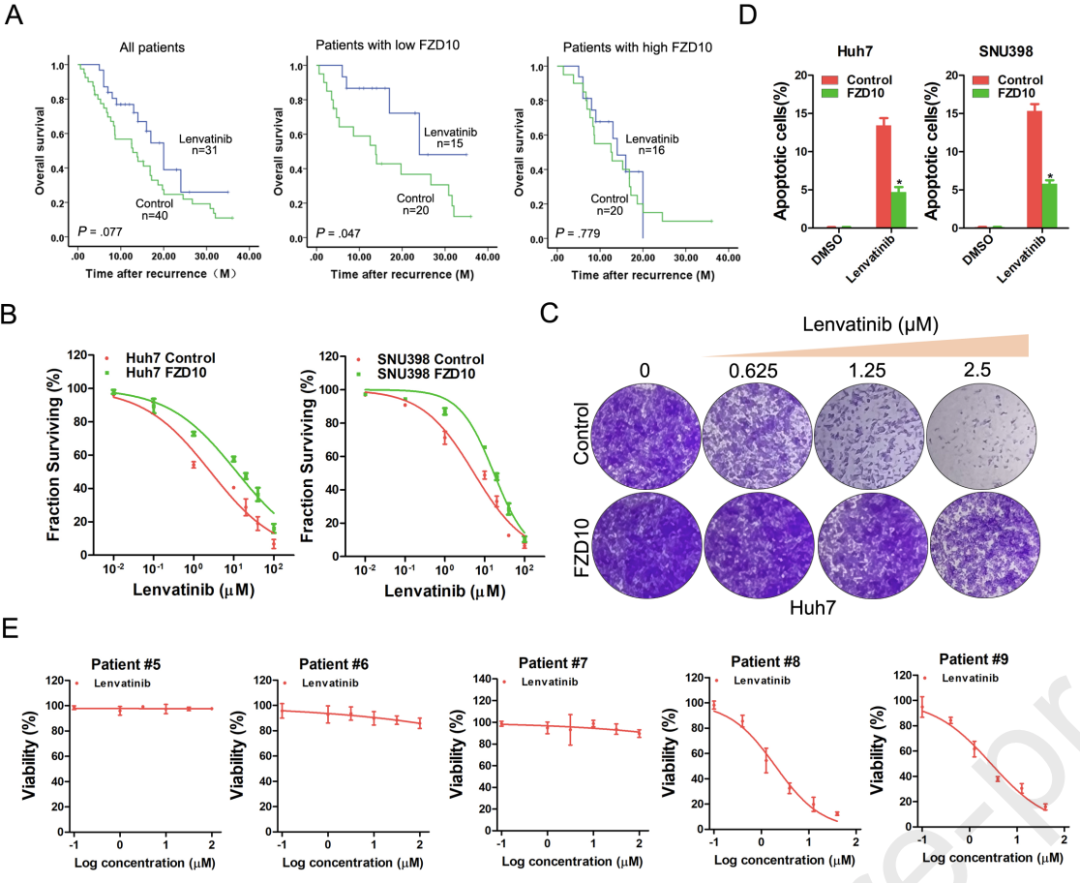
FZD10表达水平与HCC患者仑伐替尼的治疗耐药性相关
研究人员还探究了FZD10高表达导致仑伐替尼耐药的机制。根据已有文献报道,MAPK信号通路异常激活与仑伐替尼耐药密切相关[4]。
与先前的研究结果相一致,本研究的RNA-seq数据显示MAPK信号通路在过表达FZD10的HCC细胞中富集。相比于对仑伐替尼仑伐替尼治疗敏感的HCC细胞系,对仑伐替尼耐药的HCC细胞系中MAPK信号通路之一c-Jun/MEK/ERK通路的表达水平显著上调,在仑伐替尼耐药的PDXs和仑伐替尼治疗后的临床复发肿瘤中,FZD10和c-Jun/MEK/ERK通路的表达水平也明显上调。
这表明c-Jun/MEK/ERK的激活与仑伐替尼耐药有关,肝癌中高表达的FZD10通过c-Jun/MEK/ERK通路导致HCC对仑伐替尼产生耐药性。
最后,研究人员评估了以FZD10为靶点对仑伐替尼耐药HCC的治疗潜力。
他们发现使用FZD10抑制剂可以恢复HCC对仑伐替尼治疗的敏感性,说明FZD10有望成为治疗仑伐替尼耐药HCC的潜在靶点。
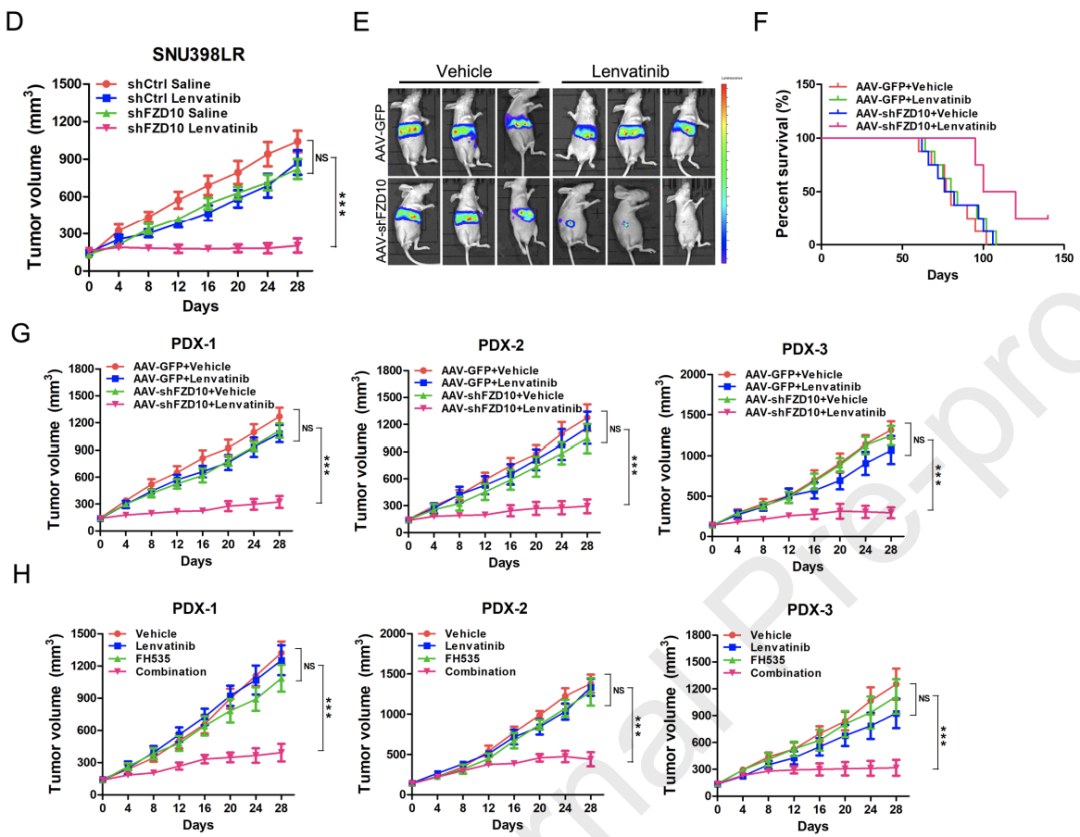
靶向FZD10可恢复HCC对仑伐替尼的敏感性
总的来说,本研究发现在肝癌CSCs中高表达的FZD10一方面可以通过激活 -catenin和YAP1促进肝脏CSCs的自我更新、肿瘤发生和转移,另一方面可以通过c-Jun/MEK/ERK通路导致肝癌细胞对仑伐替尼治疗产生耐药性。
机制示意图
好消息是,靶向FZD10可以恢复HCC对仑伐替尼的治疗敏感性,提高其临床治疗效果,这也意味着FZD10可以作为一种新的肝癌预后生物标志物和仑伐替尼耐药HCC的治疗靶点。
参考文献:
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021. CA Cancer J Clin 2021;71:7-33.
[2] Wang J, Yu H, Dong W, Zhang C, Hu M, Ma W, Jiang X, Li H, Yang P, Xiang D. M6A-mediated upregulation of FZD10 regulates liver cancer stem cells properties and lenvatinib resistance through WNT/ -catenin and Hippo signaling pathways. Gastroenterology. 2023 Feb 8:S0016-5085(23)00114-2.
[3] Han T, Zhang Y, Yang X, et al. miR-552 Regulates Liver Tumor-Initiating Cell Expansion and Sorafenib Resistance. Mol Ther Nucleic Acids 2020;19:1073-1085.
[4] Jin H, Shi Y, Lv Y, et al. EGFR activation limits the response of liver cancer to lenvatinib. Nature 2021.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:免疫系统不认“脸”,只认“伤”?“细胞破损”才是拉响过敏警报的通用语言 (2025-08-07)
- 陆军军医大学最新论文登上Cell头条 (2025-08-07)
- Cell重磅:AI从头设计生成小型结合蛋白,大幅提高先导编辑效率 (2025-08-07)
- 《自然·医学》:改良DASH,帮助控糖!约翰霍普金斯团队发现,DASH4D饮食方案可显著改善2型糖尿病患者的血糖控制 (2025-08-07)
- PNAS:免疫疗法新突破!NOD2基因变异助力癌症治疗 (2025-08-06)
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |
|


















