《细胞发现》:分析近10万个细胞,复旦附属中山医院团队发现了肝癌免疫逃逸新机制! |
 |
来源:奇点糕 2023-03-27 11:21
该研究通过对HCC单细胞水平转录组的研究,发现了一种与免疫抑制性微环境相关的癌相关成纤维细胞亚群,并确定了其介导肿瘤细胞免疫逃避的机制。同时,该研究还提出了一种可有效提高HCC免疫抑制剂疗效的辅助治疗肝细胞癌(HCC)作为全球第六大常见癌症类型,由于通常其确诊时间较晚,每年会导致近83万的死亡[1]。
针对晚期的治疗,当前主流手段包括多激酶抑制剂索拉菲尼、仑伐替尼等的使用。随着具有里程碑意义的IMbrave150临床试验结果的发表,检查点抑制剂正逐步改变晚期肝癌的治疗方式[2]。
但是与黑色素瘤、微卫星不稳定型肿瘤相比,肝癌对免疫检查点抑制剂响应率较低。因此,了解肝癌免疫疗法的耐药机制,以及开发针对肝癌更有效的免疫治疗策略,是当前肝癌治疗领域一大研究重点。
近日,由复旦大学附属中山医院史颖弘、樊嘉和刘卫仁领衔的研究团队,在著名期刊Cell Discovery上发表重要研究成果[3]。
他们发现,肝癌组织中的CD36+癌相关成纤维细胞(CAFs),可以通过分泌巨噬细胞迁移抑制因子(MIF),募集CD33+髓源性抑制细胞(MDSCs),为肝癌细胞提供抑制性的免疫微环境,使之逃过免疫系统的监视。而CD36抑制剂(SSO)和PD-1抑制剂的联合使用,可以恢复抗肿瘤T细胞反应,抑制肝癌的发展。
该研究揭示了HCC免疫疗法耐药新机制,为提高HCC免疫疗法的治疗效果提供了新思路。

论文首页截图
HCC肿瘤微环境的一大标志性特征是具有大量的CAFs。
这类细胞可以通过分泌多种细胞因子、趋化因子以及生长因子,直接或者间接的促进癌细胞的免疫逃避和肿瘤发展。许多研究已经表明,不同CAFs亚群可以通过与癌细胞相互作用,促进癌症发展[4]。
但是,目前人们对HCC中CAFs的异质性,特别是单细胞层面这些细胞与癌细胞的相互作用,仍然知之甚少。
鉴于此,研究人员利用单细胞测序手段,对来自7位HBV相关HCC患者的肿瘤组织和邻近正常肝组织的90572个细胞进行了转录组分析。根据标志基因ACTA2、COL1A1和COL1A2的表达,研究人员得到了1835个CAFs。
进一步聚类分析显示,这些CAFs可以被分为5个亚群。根据这些亚群GO和KEGG富集分析的结果,研究人员将它们分别命名为:相关CAFs(vCAFs)、基质相关CAFs(mCAFs)、脂质代谢-基质相关CAFs(lpmCAFs)、脂质代谢相关CAFs(lpCAFs)和抗原呈递相关CAFs(apCAFs)。
这些CAFs亚群在模拟人HCC遗传背景的CTNNB1N90;Trp53KOHCC小鼠模型中也存在。
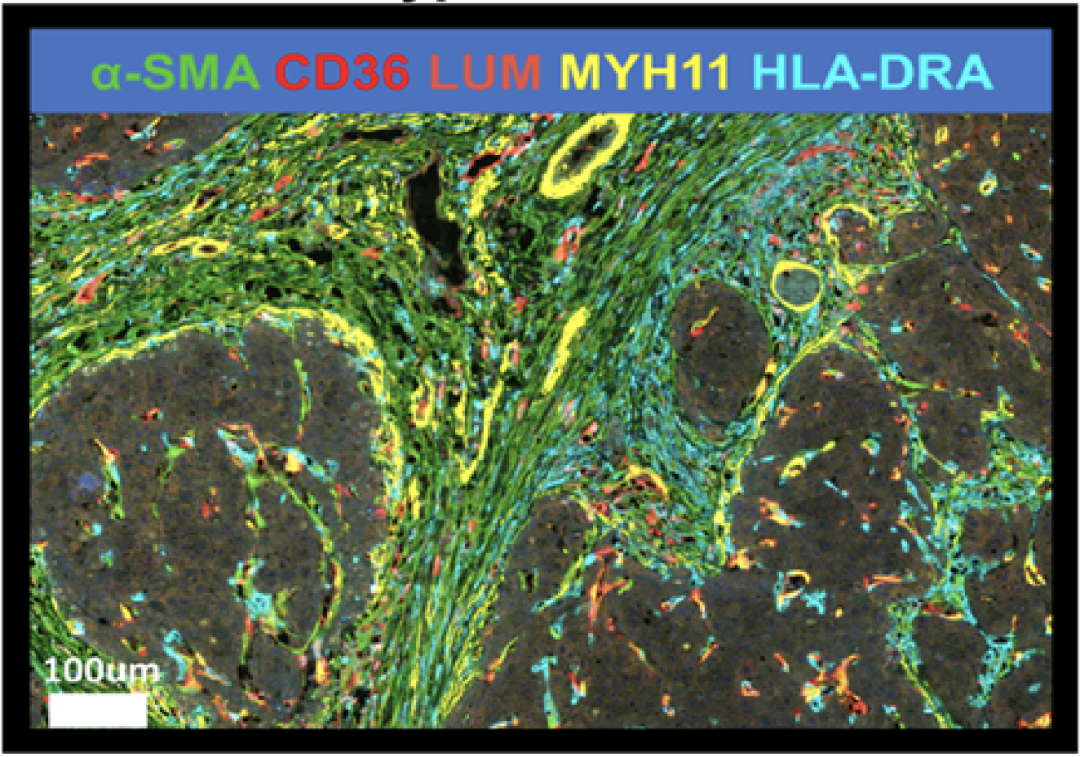
HCC肿瘤微环境存在多种CAFs亚型
为了了解不同细胞类型之间的联系,研究人员对包括癌细胞、T细胞、B细胞、MDSCs以及CAFs等9种细胞类型,进行了配体受体互作分析。
结果显示,CAFs与免疫微环境中包括MDSC等多种免疫细胞之间,都存在着由MIF和CD74/CXCR4介导的相互作用。进一步分析显示,MIF配体主要来源于lpmCAFs和lpCAFs这两个亚群。有意思的是,这两个亚群都高表达CD36。
多重荧光免疫组化结果显示,这些CD36+CAFs只在肿瘤组织中有浸润,在邻近正常肝组织中并不存在。
另外,单细胞数据结果显示,CD36+CAFs的细胞丰度与MDSCs的细胞丰度呈正相关,与效应T细胞的细胞丰度呈负相关。这意味着CD36+CAFs可能具有免疫抑制作用。
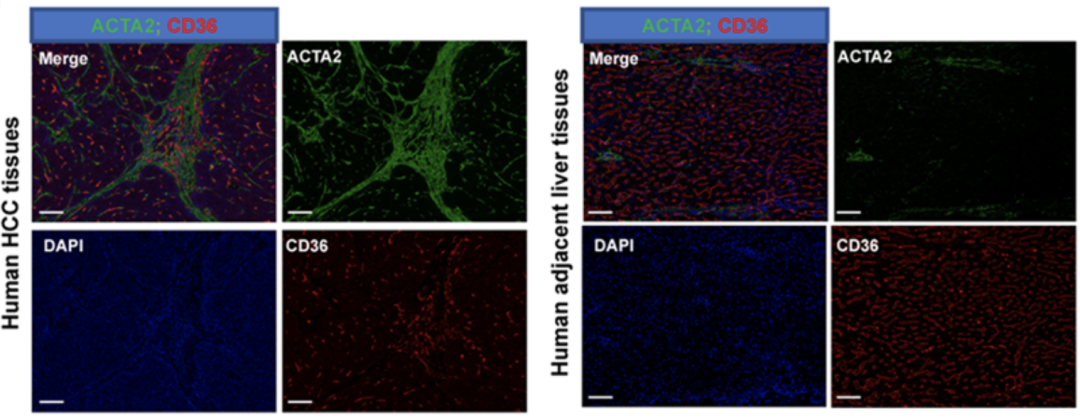
CD36+CAFs特异性浸润在肿瘤组织中,且其细胞丰度与抑制性的免疫微环境相关
为了弄清楚CD36+CAFs以及MIF在HCC发展过程中扮演的角色,研究人员分离出了小鼠HCC组织中CD36+CAFs,并比较了敲低CD36前后CAFs转录组和功能的变化。
结果显示,敲低CD36后,该CAF亚群中MIF的表达、分泌水平下降,且脂质过氧化功能及相关基因的表达下降,对氧化低密度脂蛋白(OxLDL)的吸收能力下降。
进一步分析显示,CD36+CAFs可以通过吸收OxLDL增强脂质过氧化功能,进而激活p38-CEBP信号通路,最终上调MIF的表达。
MIF在肿瘤微环境中的作用已有报道,包括促进免疫抑制性单核细胞样MDSCs的富集[5]。因此,研究人员分析比较了CD36+CAFs、CD36-CAFs、CD36kdCAF的调节培养基,对MDSC增殖分化过程的影响。
结果显示,CD36+CAFs调节培养基可以诱导CD33+MDSCs的扩增,效果与添加了MIF的培养基类似。而在CD36+CAFs调节培养基中添加MIF抑制剂,或者使用CD74抗体阻断MIF-CD74相互作用,可以抑制CD33+MDSCs的扩增。
进一步体内实验结果显示,相较于肝脏原位共同注射了HCC细胞和CD36-CAFs的小鼠,共同注射了CD36+CAFs的小鼠肿瘤发展明显加快,其微环境中CD8+效应T细胞明显减少,而敲低CD36、使用MIF抑制剂或者使用抗体清除MDSC,均可以逆转这些变化。这些结果说明,CD36+CAFs可以通过分泌MIF来促进MDSCs的增殖,进而营造一个利于肿瘤发展的抑制性免疫微环境。
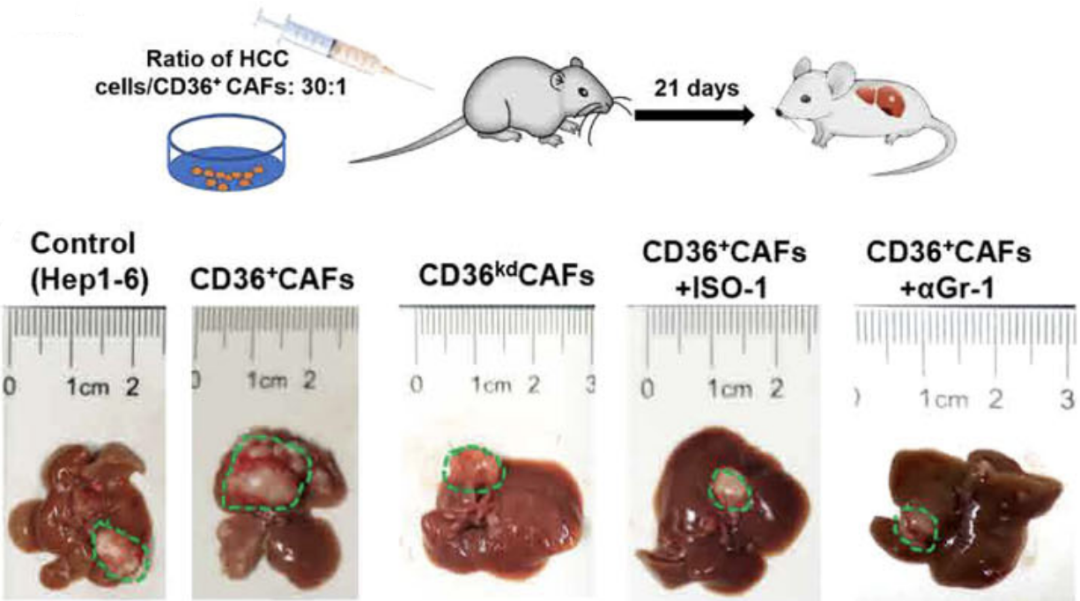
CD36+CAFs来源的MIF通过促进MDSC扩增来营造抑制性的免疫微环境
另外,研究人员还发现,CD36+CAFs可以诱导MDSC增强肿瘤细胞的干性,并且该作用可能是通过IL-6-STAT3通路实现的。
CD36+CAFs在HCC的发生及对免疫疗法的响应过程中同样扮演重要角色。研究人员发现,对比正常小鼠,成纤维细胞中敲除了Cd36或者Mif基因的小鼠,在尾静脉注射实验中形成了更少数量的肿瘤,且具有更长的生存期。
而且联合使用CD36抑制剂(SSO)和PD-1抑制剂,可以有效减少肿瘤微环境中Treg和MDSCs的丰度,增加CD8+效应T细胞丰度,控制肿瘤发展,显著改善小鼠生存期。
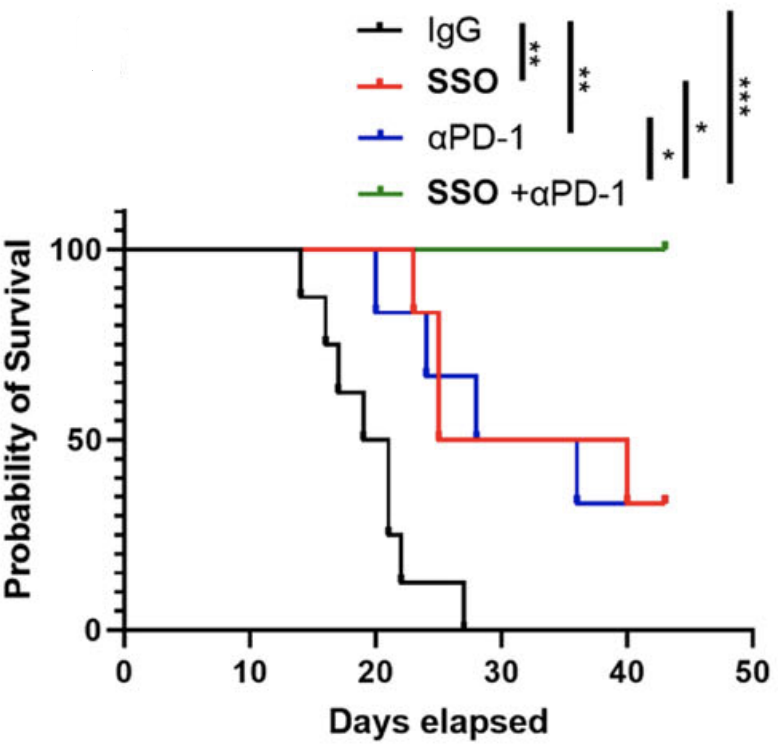
抑制CD36/MIF能提高PD-1抑制剂的抗肿瘤效果
总的来看,该研究通过对HCC单细胞水平转录组的研究,发现了一种与免疫抑制性微环境相关的癌相关成纤维细胞亚群,并确定了其介导肿瘤细胞免疫逃避的机制。同时,该研究还提出了一种可有效提高HCC免疫抑制剂疗效的辅助治疗思路,即通过靶向CD36来逆转抑制性的微环境。
参考文献:
[1] Sung, Hyuna, et al. "Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries."CA: a cancer journal for clinicians71.3 (2021): 209-249.
[2] Yang, Chen, et al. "Evolving therapeutic landscape of advanced hepatocellular carcinoma."Nature Reviews Gastroenterology Hepatology(2022): 1-20.
[3] Zhu, Gui-Qi, et al. "CD36+ cancer-associated fibroblasts provide immunosuppressive microenvironment for hepatocellular carcinoma via secretion of macrophage migration inhibitory factor."Cell Discovery9.1 (2023): 25.
[4] Liu, Tongyan, et al. "Cancer-associated fibroblasts: an emerging target of anti-cancer immunotherapy."Journal of hematology oncology12.1 (2019): 1-15.
[5] Noe, Jordan T., and Robert A. Mitchell. "MIF-dependent control of tumor immunity."Frontiers in immunology11 (2020): 609948.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 健康赋能每一步,扬子江龙凤堂2025泰州马拉松赛鸣枪开跑 (2025-10-20)
- 槲皮素哪个品牌好?肺结节人群看过来!2005槲皮素品牌排行榜,吉清肺改善率超93% (2025-10-20)
- 清肺润肺哪个牌子好?2025槲皮素十大护肺品牌推荐,吉清肺GRANVER针对不同人群显成效? (2025-10-20)
- Nature Medicine:这个基因突变,会导致肥胖,但能抵御心脏病 (2025-10-19)
- 《柳叶刀》子刊:艾扬格瑜伽,增加跌倒风险!随机对照试验结果显示,与坐姿瑜伽相比,艾扬格瑜伽与老年人跌倒风险增加33%相关 (2025-10-19)
- 《自然·神经科学》:中国科学家揭示深脑刺激治疗帕金森病的神经机制,并发现更安全、成本更低的替代方法! (2025-10-19)
- 2025年槲皮素哪个牌子效果最好?2025年十大槲皮素清肺品牌排行榜,清肺护肺哪个好? (2025-10-19)
- 赛诺菲胰岛素原料药项目启动,助力北京打造全球医药健康产业高地 (2025-10-18)
- Nature Medicine:首次人体实验,PD-1单抗治疗艾滋病 (2025-10-18)
- 百年药企参天公司旗下维生素B12滴眼液参天玫瑰®焕新上市 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















