Cancer Cell:中山大学邝栋明/魏瑗团队揭示癌周交叉呈递削弱了肝癌免疫治疗效果 |
 |
来源:生物世界 2024-11-27 10:04
研究团队建议,将抗PD-1/PD-L1等免疫检查点阻断(ICB)疗法与重新分布CD103+CTL的药物联合,可能有助于肝细胞癌(HCC)的治疗。中山大学生命科学院邝栋明教授、魏瑗副教授等在CancerCell 期刊发表了题为:Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma 的研究论文。
该研究揭示了肝(HCC)中,癌周巨噬细胞通过内质网(ER)相关的降解机制介导的胞质途径途径将抗原交叉呈递给肿瘤反应性细胞毒性T淋巴细胞(CD103+CTL),这一过程导致CD103+CTL滞留在癌周区域,从而激活巨噬细胞中的NLRP3炎症小体,促进进展和治疗抵抗。
对HCC患者的单细胞RNA测序(scRNA-seq)和空间转录组学分析表明,尽管存在组织驻留效应细胞表型,但CD103+CTL的聚集预示着接受多种治疗的HCC患者的不良临床结局。相应地,靶向肿瘤微环境中CD103+CTL重新分布的治疗策略,不仅能促进肿瘤内CD103+CTL的浸润,还能削弱癌周巨噬细胞的促肿瘤炎症反应,从而增强免疫检查点阻断(ICB)疗法对HCC的治疗效果。

CTL的克隆扩增和反应性通常是由MHC I分子呈递来自和病毒感染细胞的外源性抗原所启动的。有趣的是,树突状细胞(DC)作为淋巴器官中的专业抗原呈递细胞,可以通过两种途径交叉呈递直接激活CTL的克隆扩增和效应功能:胞质途径利用新合成的MHC I分子呈递由蛋白酶体降解的内化的外源性抗原,而液泡途径利用内化的MHC I分子呈递由溶酶体降解的抗原。然而,在肿瘤微环境中,树突状细胞的发育和成熟往往受到阻碍,而促肿瘤生成的巨噬细胞构成了主要的专业抗原呈递细胞。因此,评估肿瘤微环境中促肿瘤巨噬细胞与CTL之间的双向相互作用,包括交叉呈递,对于理解它们在肿瘤发生中的作用和潜在机制至关重要。
基于肿瘤微环境中免疫细胞的绝对数量和空间分布,实体肿瘤的免疫特征可以分为三种亚型:免疫富集型、免疫排斥型和免疫荒漠型。这些亚型中,免疫排斥型指的是CTL聚集在肿瘤周围的癌周间质而不是肿瘤巢内。
截至目前,在癌症患者中,尤其是接受免疫疗法的癌症患者中,癌周CTL的特性、聚集机制和生物学功能仍不明确。
肝细胞癌(HCC)通常发生在有炎症的肝脏中,因此肿瘤部位的炎症环境会对的行为和治疗效果产生显著影响。
在这项最新研究中,研究团队发现,尽管癌周CTL表现出具有克隆扩增和高反应性的CD103+组织驻留效应表型,但这些细胞的聚集预示着接受手术切除、ICB疗法、手术切除+ICB疗法,以及ICB疗法+经动脉灌注化疗的患者的不良治疗结局。
从机制上来说,癌周巨噬细胞的交叉呈递导致了CD103+CTL在肝细胞癌肿瘤的癌旁区域的保留。重要的是,交叉呈递后,癌周CD103+CTL诱导巨噬细胞中NLRP3的活化和随后的炎症反应,从而为肝癌进展和减弱免疫治疗效力创造有利条件。
该研究的核心发现:
癌周CD103+克隆扩增的CTL预示着较差的免疫治疗效果;
癌周巨噬细胞的交叉呈递导致了肝细胞癌(HCC)中CD103+CTL的滞留;
反应性CTL通过激活NLRP3炎症小体启动巨噬细胞的致病性;
CD103+CTL的重新分布可增强免疫治疗效果;
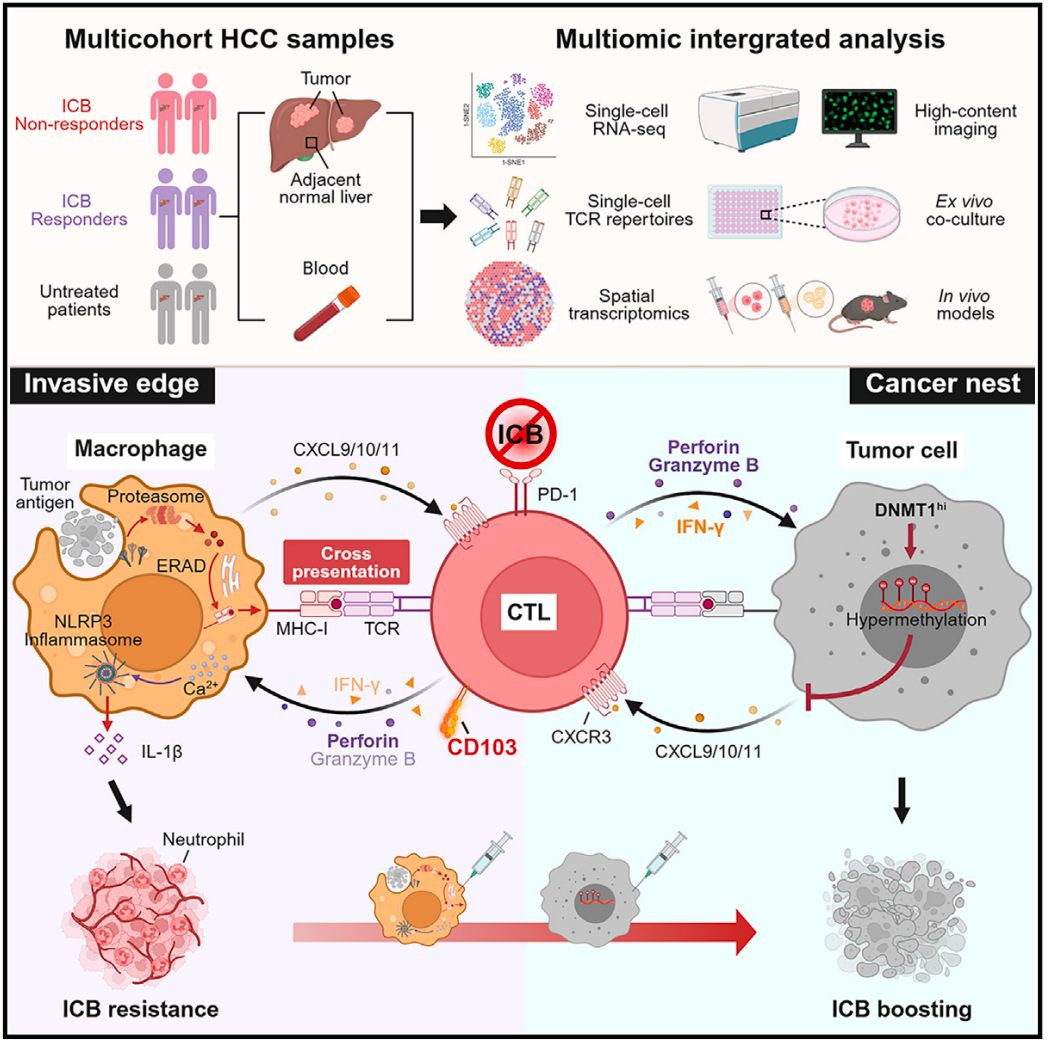
鉴于这些发现,研究团队认为,研究选择性调节效应CTL空间定向的机制可能带来癌症治疗新策略。研究团队建议,将抗PD-1/PD-L1等免疫检查点阻断(ICB)疗法与重新分布CD103+CTL的药物联合,可能有助于肝细胞癌(HCC)的治疗。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 研究揭示认知控制大脑活动随年龄呈倒U型发展轨迹 (2025-09-13)
- 炎症TSLP赛道,有“弃子”变“黑马” (2025-09-13)
- Nature:科学家成功利用新算法揭开癌症“黑匣子”并预测肿瘤的演变和临床进程 (2025-09-13)
- Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制 (2025-09-12)
- Nat Commun:口腔微生物界的“超级英雄”!科学家揭示细胞外遗传元素Inocle的发现与意义 (2025-09-12)
- Trends Biotechnol.:武汉大学陈刚/余自力等团队提出FACTORY全自动 EV 分离平台,把 EV 分离从“小作坊”直接升级成“标准化工厂” (2025-09-12)
- EMBO Mol Med:罕见基因突变有望揭示肠道干细胞的再生奥秘 (2025-09-11)
- STTT:打断肿瘤的“狗腿”!科学家发现,抑制中性粒细胞的STAT3,会让中性粒细胞“改邪归正”,促进T细胞抗癌 (2025-09-11)
- Cell:IL-25诱导的记忆2型固有淋巴细胞,强化黏膜免疫 (2025-09-11)
- Nature Medicine:靶向休眠肿瘤细胞,预防乳腺癌复发 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















