Nature:揭示脂肪肝炎如何发展成肝癌 |
 |
来源:医诺维 2025-01-05 10:42
研究解决了衰老细胞状态与肝癌之间关联的矛盾,揭示了FBP1在调控肝细胞衰老和HCC发展中的关键作用,以及FBP1与p53和NRF2之间的相互作用。加州大学的研究人员在Nature 期刊发表了题为:FBP1 controls liver cancer evolution from senescent MASH hepatocytes 的研究论文。
研究解决了衰老细胞状态与之间关联的矛盾,揭示了FBP1在调控肝细胞衰老和HCC发展中的关键作用,以及FBP1与p53和NRF2之间的相互作用。
结果表明,FBP1的丧失通过AKT激活促进了肿瘤发生,而FBP1的重新表达可以抑制HCC的发展。
代谢相关脂肪性肝炎(MASH)的特征是脂质堆积和炎症,它使肝细胞进入一种称为衰老(senescence)的肿瘤抑制状态,但同时又增加癌症风险。该团队对这一悖论的研究表明,诱导 MASH 的饮食通过引起 DNA 损伤来触发衰老。然而,长时间的代谢应激使这些衰老的肝细胞开始分裂并进展为癌症。

图:参考文献
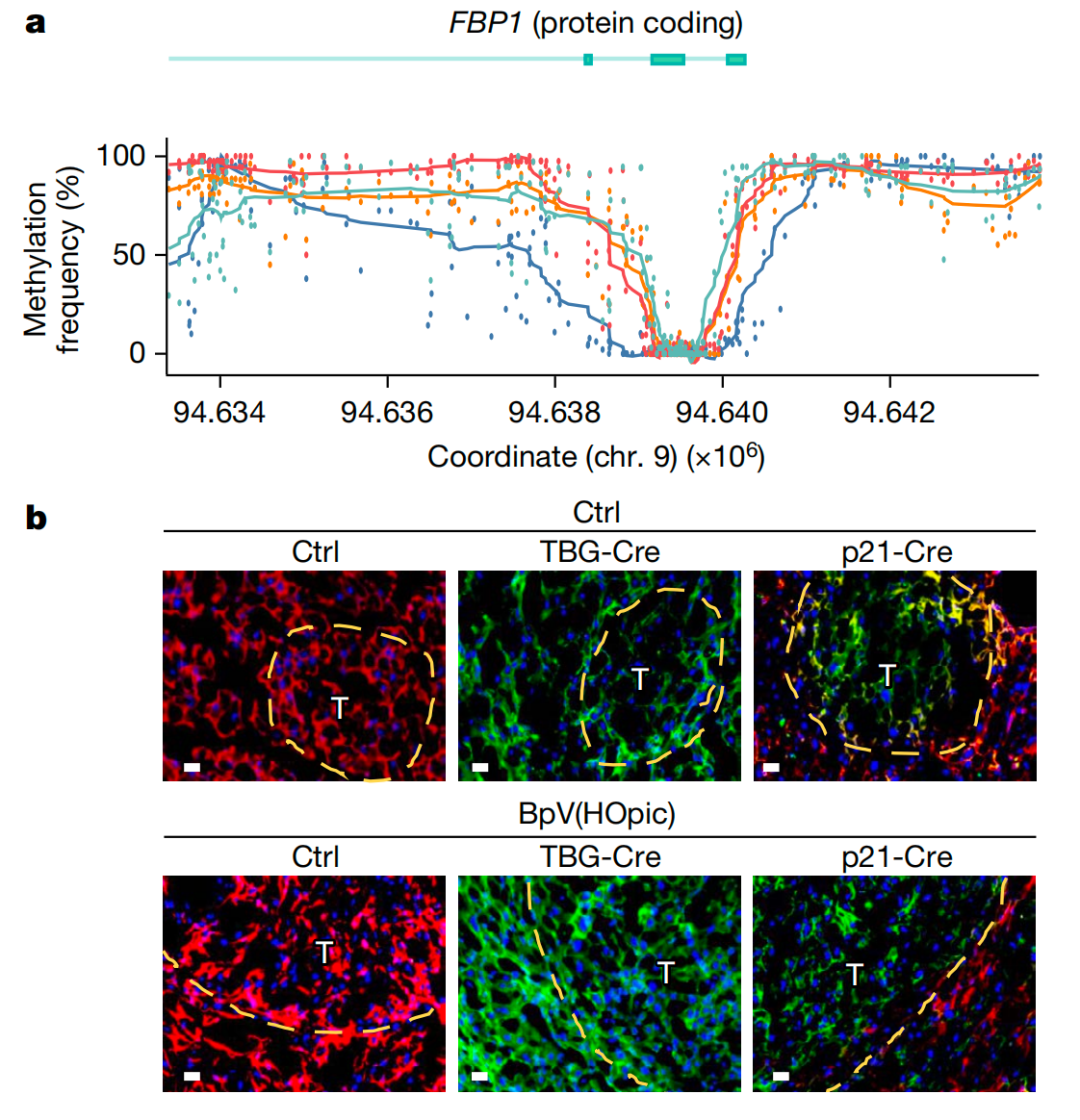
之前的研究表明,肝癌可被糖异生酶果糖-1,6-二磷酸酶1(FBP1)抑制。在这项最新研究中,研究团队发现,人类肝(HCC)样本中的 FBP1 水平低于正常水平,这与肿瘤抑制蛋白 TP53 的减少情况相一致。研究团队还观察到促癌酶 AKT 的激活,而 FBP1 有助于其失活。已知 AKT 可加速 TP53 降解并稳定促癌转录激活蛋白 NRF2。此外,研究团队还观察到,在肝细胞癌(HCC)中,FBP1 基因发生了甲基化修饰,这种修饰阻止了转录激活因子(例如TP53)对其表达的促进作用。
出乎意料的是,与对照组相比,在人类 MASH 样本和小鼠模型中,FBP1 和 TP53 水平较高,而 AKT 和 NRF2 水平较低。
MASH 诱导饮食的小鼠模型的肝细胞会出现 DNA 损伤。这引发了 DNA 损伤应答,随后 TP53 被激活,FBP1 表达升高以及衰老的分子标志物增多。研究团队探究了 DNA 损伤的肝细胞如何逃避衰老并发展为肝细胞癌。他们发现,一组被称为疾病相关肝细胞(daHep)的细胞,表现出 NRF2 和 AKT 的激活,以及相对较低水平的 TP53 和 FBP1。
这些疾病相关肝细胞,与肝细胞癌祖细胞相似,它们在癌前肝脏中形成紧密排列的细胞簇。激活的 NRF2 在肝细胞中的存在会促进 FBP1 和 TP53 的降解,并使细胞脱离衰老状态。当小鼠经过基因工程改造而缺乏 FBP1 时,携带 MASH 或其肝细胞表达致癌突变蛋白 NRASG12V(该突变蛋白也会损伤 DNA 并诱导衰老)的小鼠的肝细胞癌发展速度加快。
值得注意的是,MASH 诱导的衰老依赖于一种感知单链 DNA 损伤的酶,而 NRASG12V也激活另一种感知双链 DNA 损伤的酶。有趣的是,在 MASH 诱导的肝细胞癌中观察到的突变表明存在单链 DNA 损伤,而在 NRASG12V引发的肿瘤中观察到的突变反映了单链和双链 DNA 断裂。细胞谱系追踪显示,大部分肝细胞癌起源于衰老的肝细胞。
基于上述发现,研究团队得出结论:尽管 MASH 诱导的衰老(senescence)减少了肝细胞的 DNA 损伤,但它在抑制肿瘤形成方面效果不佳。事实上,通过阻止 DNA 损伤的肝细胞分裂,衰老反而会增加患,因为它促进了突变的肝细胞癌祖细胞的存活。
衰老状态是不稳定的,在长期的代谢压力之后,疾病相关肝细胞(daHep)会重新进入细胞分裂周期,进而发展为肝细胞癌(HCC)。研究团队进一步推测,由 DNA 损伤的祖细胞引发的其他癌症,无论是否具有仅存在于肝脏和肾脏中的 FBP1,都遵循相同的途径。
事实上,许多癌症都是由衰老的癌前病变(比如皮肤上的痣)发展而来的,这些病变中包含着 DNA 损伤的细胞,这些细胞在逃脱衰老状态后会迅速分裂。即使表达野生型 TP53 并且具有功能性的 DNA 损伤应答,在接受 DNA 损伤疗法时也可能会进入衰老状态。在治疗停止后,此类细胞可能会产生具有许多突变的后代,这些后代特别具有侵袭性且难以根除。
肝细胞衰老和肝癌形成之间的复杂关系(图:参考文献)
对于这项研究,Nature 期刊编辑表示,MASH 是全球增长最快的肥胖相关疾病之一,可进一步发展为肝癌。在最近十年里,该领域进行了大量投入和研究,但这种疾病仍然很难治疗。这项最新研究揭示了肝脏代谢、炎症、衰老和癌症之间的相互作用,加深了我们对 MASH 进展到肝癌的理解。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- “诺奖风向标”拉斯克奖出炉,相分离研究先驱获奖,他们阐明了低复杂度结构域的结构和功能 (2025-09-13)
- 研究揭示认知控制大脑活动随年龄呈倒U型发展轨迹 (2025-09-13)
- 炎症TSLP赛道,有“弃子”变“黑马” (2025-09-13)
- Nature:科学家成功利用新算法揭开癌症“黑匣子”并预测肿瘤的演变和临床进程 (2025-09-13)
- Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制 (2025-09-12)
- Nat Commun:口腔微生物界的“超级英雄”!科学家揭示细胞外遗传元素Inocle的发现与意义 (2025-09-12)
- Trends Biotechnol.:武汉大学陈刚/余自力等团队提出FACTORY全自动 EV 分离平台,把 EV 分离从“小作坊”直接升级成“标准化工厂” (2025-09-12)
- EMBO Mol Med:罕见基因突变有望揭示肠道干细胞的再生奥秘 (2025-09-11)
- STTT:打断肿瘤的“狗腿”!科学家发现,抑制中性粒细胞的STAT3,会让中性粒细胞“改邪归正”,促进T细胞抗癌 (2025-09-11)
- Cell:IL-25诱导的记忆2型固有淋巴细胞,强化黏膜免疫 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















