Science:外源DNA的生存之道——基因如何适应陌生宿主? |
 |
这一现象提示我们,DNA序列不仅仅编码遗传信息,它本身就携带了 可读性 信号,决定其在宿主细胞中的适应方式。这与真核细胞中基因表达的广泛模式相吻合,例如在人类基因组中,高GC区域往往与开放染色质(euchromatin)相关,而低GC区域更可能位于转录沉默区。
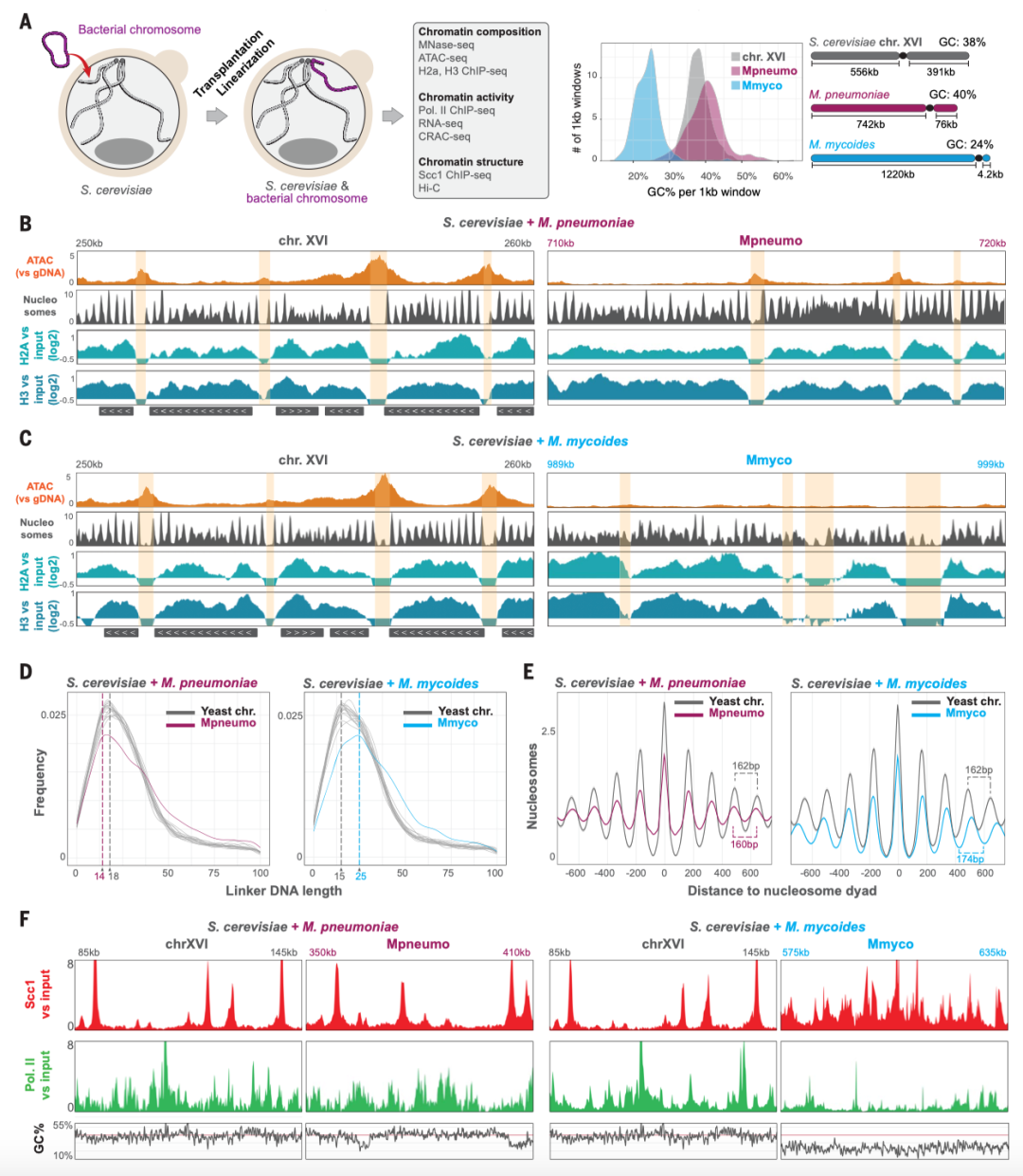
酵母细胞内整合的细菌染色质组成分析(Credit:Science)
(A) 细菌染色体在酵母中的整合及GC含量分布
细菌染色体在酵母细胞中由环状(circular)转变为线性(linear),并整合到酵母基因组中。紫色代表肺炎支原体(Mpneumo),蓝色代表山羊支原体(Mmyco)。右侧的图示展示了1 kb窗口GC含量分布:**酵母16号染色体(Chromosome XVI)**的GC含量分布较均匀。Mpneumo染色体GC含量较低,呈现更窄的分布范围。Mmyco染色体GC含量最低,表现出显著的AT富集特征。这一结果表明,外源细菌DNA的GC组成明显不同于宿主酵母基因组,可能影响其染色质结构及基因表达模式。
(B, C) ATAC-seq、核小体定位及组蛋白修饰分析
研究者利用ATAC-seq(开放染色质区域测序)、MNase-seq(微球菌核酸酶切割测序)和ChIP-seq(染色质共沉淀测序),分析了Mpneumo和Mmyco染色体在酵母细胞核中的染色质特征。ATAC-seq(橙色)数据表明,Mpneumo染色体中部分区域具有较高的染色质开放性,但总体上比酵母染色体更加致密。MNase-seq(灰色)显示核小体(nucleosome)在细菌染色体上的排布方式与宿主酵母基因组不同。ChIP-seq(H2A和H3组蛋白修饰)数据显示,Mpneumo和Mmyco染色体在酵母核内的核小体结合模式有所不同,尤其是Mmyco染色体更趋向形成紧密染色质结构,可能导致转录活性降低。这些结果表明,尽管细菌染色体可以在酵母细胞核内形成染色质结构,但其核小体排布模式和宿主基因组存在显著差异,可能影响基因表达的可及性。
(D) 细菌染色体上的核小体连接DNA长度分布
研究人员分析了核小体之间的连接DNA(linker DNA)长度,并与酵母基因组相比。Mpneumo和Mmyco染色体的核小体连接DNA长度呈现不同分布模式,但整体上短于酵母基因组。在所有测量范围内(0-100 bp),核小体连接DNA的主要峰值落在14 bp和25 bp处(虚线和点线所示)。Mmyco染色体的核小体连接长度更短,进一步支持其更致密的染色质结构,与低转录活性相吻合。这说明,细菌染色体进入酵母后,会形成独特的核小体结构,其连接DNA长度可能与宿主基因组的调控方式不同,影响基因表达的可塑性。
(E) Mpneumo和Mmyco染色体的核小体密度分布
研究者对酵母、Mpneumo 和 Mmyco 染色体上的核小体密度进行了对比。Y轴代表核小体信号强度(MNase-seq测序),结果表明:酵母基因组的核小体排布较为均匀,核小体峰值与基因活跃区域高度相关。Mpneumo染色体的核小体排列较为分散,部分区域存在核小体缺失(Nucleosome-depleted regions,黄色高亮区域)。Mmyco染色体的核小体排列更加紧密,呈现出类似异染色质的特征,可能导致更低的基因转录活性。这些数据表明,不同的细菌染色体在酵母细胞核中的适应性不同,其核小体排布方式影响着外源DNA的染色质结构,并可能进一步影响基因调控模式。
(F) Scc1和RNA聚合酶II(RNA Pol II)的ChIP-seq分析
Scc1(红色)是染色体结构调控蛋白,RNA Pol II(绿色)是转录起始的关键酶,它们的ChIP-seq数据表明:在酵母16号染色体区域(宿主基因组),RNA Pol II信号较强,表明该区域存在活跃的转录活动。在Mpneumo染色体区域,RNA Pol II信号相对较弱,但仍可检测到部分转录活跃区域。在Mmyco染色体区域,RNA Pol II信号几乎检测不到,表明其基因基本处于转录沉默状态。Scc1在Mmyco染色体上的结合信号较高,提示其可能参与了Mmyco染色质的紧密折叠,从而进一步限制了基因转录。
宿主细胞的 审查 机制:如何识别并处理外源DNA?
宿主细胞并不会无差别地接受所有进入细胞核的DNA,而是拥有一套复杂的 审查 机制,决定哪些外源DNA可以被转录,哪些会被沉默,甚至降解。
该研究的实验数据表明,外源DNA的染色质状态不仅取决于其GC含量,还受到宿主细胞染色质结构的影响。例如,研究人员观察到,低GC含量的外源DNA进入宿主后,几乎不会被RNA聚合酶(RNA polymerase)招募,这意味着宿主的转录机器默认将其 屏蔽 在基因表达网络之外。这与真核生物基因组的异染色质区高度相似,说明即便没有特定的抑制因子,DNA的序列信息本身就决定了它是否容易被转录。
此外,研究还发现,外源DNA的序列特征会影响它在细胞核内的空间分布。高GC外源DNA往往位于核中心,而低GC外源DNA则倾向于被推向核边缘,这与真核生物的染色质分区模式类似。在哺乳动物细胞中,异染色质通常集中在核膜附近,而活跃的染色质更靠近核内中心区域。该研究的结果表明,即便在进化较远的酵母中,这种基因组空间组织的原则依然适用,说明它可能是一种广泛存在的生物学规律。
真核生物的适应策略:为什么某些序列更容易被接纳?
DNA在宿主细胞中的命运并非随机,而是受一系列进化选择压力影响的结果。真核生物的基因组演化过程中,一直在筛选那些更容易整合到自身调控网络中的序列,而外源DNA是否能被接纳,很大程度上取决于它与宿主现有基因组的相似度。
研究人员发现,当外源DNA的GC含量与宿主基因组相近时,它们更容易被细胞核 接受 ,并在染色质中找到合适的位置。这一现象可以用 基因组兼容性 (genomic compatibility)来解释 宿主细胞更倾向于接纳与自身基因表达模式相匹配的DNA。这不仅解释了为什么某些外源基因更容易被整合,还为基因工程和合成生物学提供了重要启示:
如果希望外源DNA在宿主细胞中高效表达,就应设计更符合宿主基因组特征的序列。例如,在人类细胞中使用高GC的DNA片段,可能会提升其转录效率。
未来的基因编辑技术可以利用这一原理,优化DNA序列以提高其适应性,减少意外的基因沉默或表达异常的风险。
人工智能 解码 基因命运 预测DNA在宿主细胞中的行为
科学的进步不仅依赖实验数据的积累,也取决于对这些数据的深度解析。近年来,人工智能(Artificial Intelligence, AI)在生物学中的应用越来越广泛,而该研究的发现也为计算建模提供了新的视角。研究人员发现,DNA序列本身决定了其在宿主染色质中的归宿,这意味着机器学习(Machine Learning, ML)可以被用来预测外源DNA的命运。通过整合实验数据与AI算法,研究人员们正在努力 解码 DNA的适应法则,为基因工程提供更精准的工具。
机器学习如何预测染色质状态? 神经网络模型的应用
该研究提供的高通量数据表明,外源DNA的GC含量及序列模式在很大程度上决定了其在宿主细胞中的适应性。这类问题极其复杂,涉及DNA序列、转录因子结合位点、染色质结构和空间定位等多个层面,而传统的方法往往难以全面解析这些因素的协同作用。
神经网络模型的应用
研究团队利用深度学习(Deep Learning)技术,建立了一套可以预测外源DNA在宿主细胞内适应性的模型。核心方法包括:
医药网新闻
- 相关报道
-
- “诺奖风向标”「霍维茨奖」揭晓,三位学者因杜氏肌营养不良症研究获奖 (2025-09-20)
- 免疫治疗守护“银发时代”!IMpower-132研究显示,阿替利珠单抗联合化疗一线治疗能为老年肺癌患者保驾护航 (2025-09-20)
- Nature:成纤维细胞——脑损伤修复的“双面卫士” (2025-09-20)
- 世界首次!登上NEJM:中国学者开发in vivo CAR-T细胞疗法,成功治疗系统性红斑狼疮 (2025-09-19)
- Amylin类似物首个单药减重III期数据读出,诺和诺德燃起新希望? (2025-09-19)
- 【9月23日直播预告】非靶代谢流线上分享会——解码代谢动态,探寻疾病机制 (2025-09-19)
- 【参会指南】9月26-27日,2025(第九届)细胞外囊泡前沿与转化大会(厦门站)即将开幕! (2025-09-18)
- 西湖大学最新Cell子刊论文:利用孕妇肠道菌群预测早产风险 (2025-09-17)
- Cell:高分子量tau蛋白抑制海马体神经元活动,导致阿尔茨海默病的认知衰退 (2025-09-17)
- 两篇《自然》:肺癌私联神经元!科学家首次发现小细胞肺癌细胞会在脑内与神经元形成突触,借助电信号促进肿瘤生长 (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















