中国细胞与基因疗法(CGT)研发趋势 |
 |
来源:医药魔方 2025-08-06 11:15
中国CAR-T细胞疗法上市后风险管理的特点是围绕产品全生命周期进行全面管控,严格保障患者安全并确保治疗效果,尤其注意监测继发性恶性肿瘤(如T细胞淋巴瘤)的出现。近日,国家药监局药品审评中心(CDE)联合清华大学团队撰写的一篇文章在《Nature Reviews Drug Discovery》期刊上发表。该文章总结了近八年来CGT(细胞与基因疗法)领域的发展趋势。

在激励政策和监管部门的支持下,中国已成为全球CGT领域日益重要的参与者。除此之外,中国还继续优化外商投资环境以鼓励CGT领域的国际合作。药品监管方面,国家药监局(NMPA)在2019年5月启动了药品监管科学行动计划[2],制定了一批监管政策、审评技术规范、检查检验评价技术、技术标准等,其中包括CGT产品技术评价与监管体系研究项目。为此,CDE发布了详细的技术指导原则,涵盖过去5年CGT领域发展的关键方面,包括化学、生产和质量控制(CMC)、非临床研究、临床药理学研究和临床研究(见下表)。本文分析了中国CGT格局变化趋势,包括临床在研和已获批准的CGT产品的特点。
CDE已发布的CGT产品指导原则
 注:截至2025年6月30日
注:截至2025年6月30日
中国CGT产品IND概况
统计数据显示,截至2025年第⼆季度,CDE共受理了765份CGT产品新药研究(IND)申请,其中细胞疗法、疗法和基因疗法占大多数。
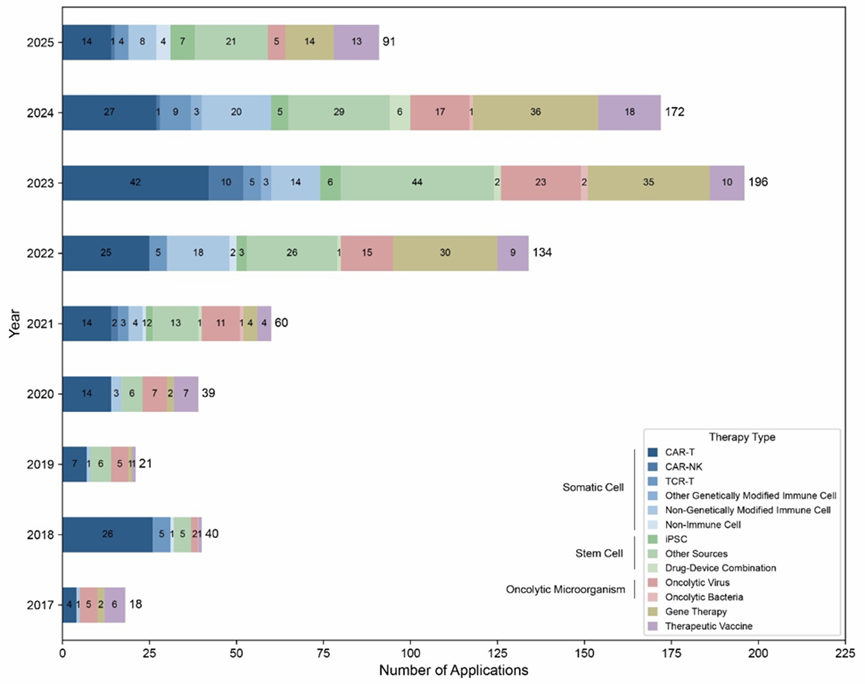 2017-2025年中国CGT产品的IND申请趋势
2017-2025年中国CGT产品的IND申请趋势
在这765份IND申请中,553份已获得批准,余下214份未通过。
拒批的常见原因包括:
1)科学依据不充分,例如作用机制不明确或目标人群的临床需求不清晰;
2)递交的初始材料不合法或不合伦理;
3)现有药物或非临床数据不足以支持开展临床试验;
4)在IIT(研究者发起的试验)中发现安全性问题;
5)在联合治疗应用中,拟议适应症或剂量方案与已批准产品的说明书不符。
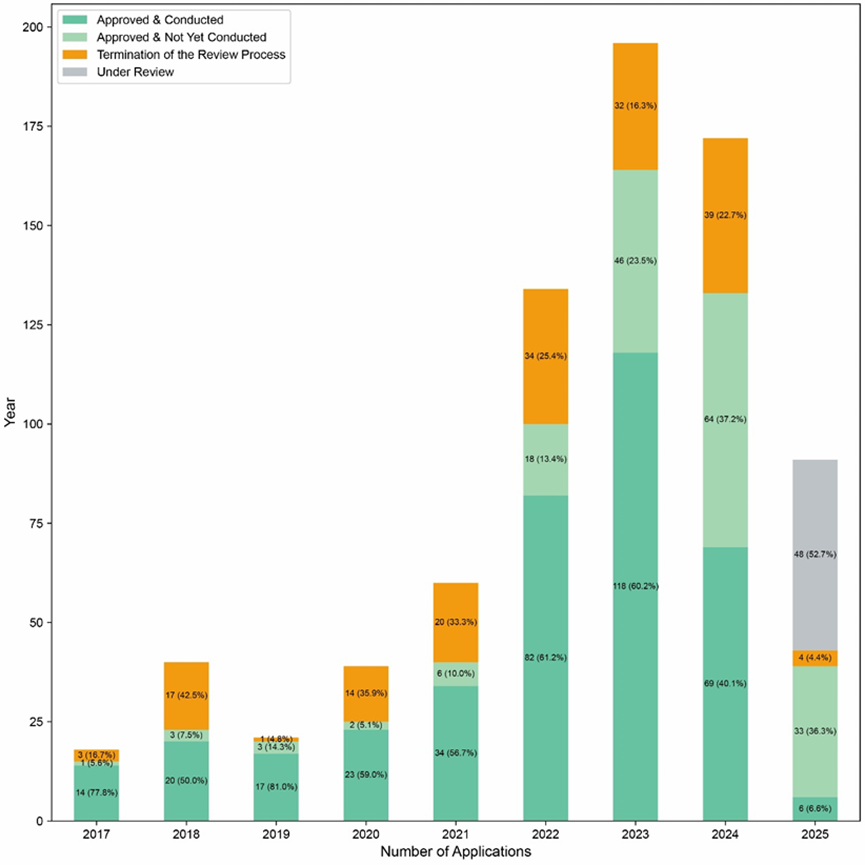 2017-2025年中国CGT产品IND申请及临床试验启动状态
2017-2025年中国CGT产品IND申请及临床试验启动状态
不过,IND申请终止数量呈现出下降趋势,这反映出支持性数据的质量有所提高,以及CDE指导原则和pre-IND流程也提供了助益,这些都将有助于在未来提供更支持CGT开发的环境。
在研CGT产品进度及特点
总体而言,CAR-T细胞疗法在所有CGT药物中开发进度最快。数据显示,近八年CAR-T细胞疗法在中国已开展72项探索性临床试验、15项验证性临床试验,已递交7项新药上市申请(NDA),已批准9项NDA。此外,还有45份CAR-T细胞疗法的IND申请已获批准,但尚未启动临床试验。
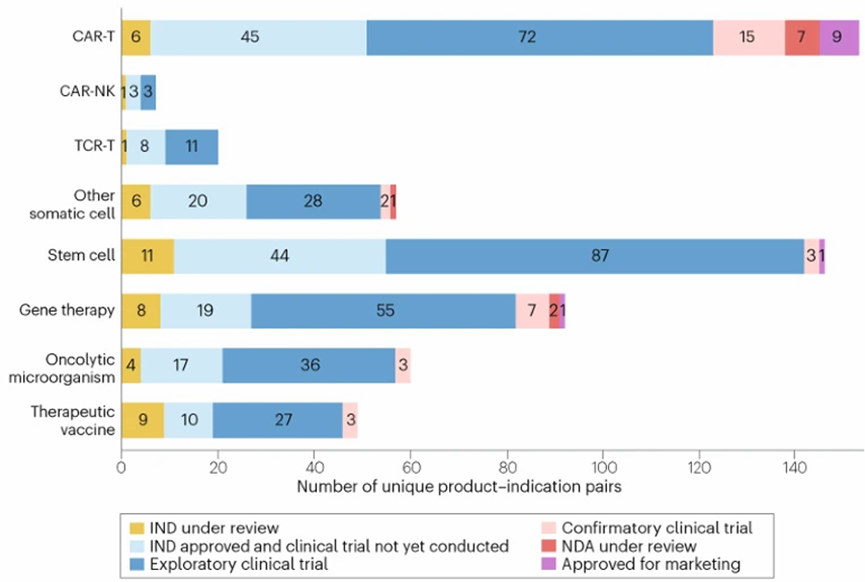 中国在研CGT产品的开发状态
中国在研CGT产品的开发状态
干细胞疗法的临床开发活跃度仅次于CAR-T细胞疗法。数据显示,44份干细胞疗法的IND申请已获批准,87项干细胞疗法的探索性试验正在开展,3项干细胞疗法的验证性试验正在开展,1款产品已获批上市(即用于治疗移植物抗宿主病的艾米迈托赛)。
基因疗法赛道也相当活跃,目前已有55项探索性试验启动、7项确证性试验启动、2款药物递交NDA以及1款产品获批上市(即用于治疗B型的波哌达可基)。
除此之外,其它CGT药物仍处于早期开发阶段。
常见的CGT药物可以分为三大类 体细胞疗法(包括CAR-T细胞疗法、CAR-NK细胞疗法和TCR-T细胞疗法)、干细胞疗法和基因疗法。
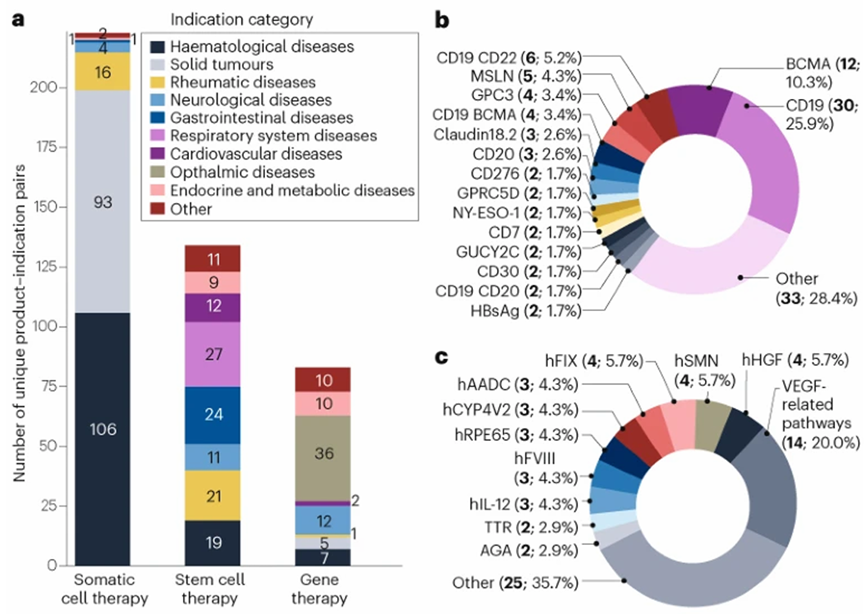 常见的三大类CGT药物的适应症和靶点分析
常见的三大类CGT药物的适应症和靶点分析
体细胞疗法主要针对癌症(包括血液瘤和实体瘤)。在针对血液瘤的体细胞疗法中,靶向在B细胞上表达的靶点最为常见,例如CD19和BCMA,多靶点体细胞疗法正在探索中。⼀项开创性的临床试验表明,经CD19 CAR-T细胞疗法治疗后的系统性红斑(SLE)患者获得了缓解,这样的结果不仅刺激了此类疗法在SLE人群中的开发,同时也促使同类疗法开始探索其他非肿瘤适应症,如和系统性硬化症。
干细胞疗法的应用范围较广,其应用取决于不同干细胞类型的具体功能特性差异。基因疗法则主要针对罕见遗传疾病,包括血友病、遗传性视网膜疾病、脊髓性肌萎缩症和先天性代谢缺陷。在眼科疾病领域,针对VEGF靶点相关通路开发基因疗法最为常见,已有14项IND申请获批。
到目前为止,NMPA已批准6款CAR-T细胞疗法上市,涉及9项适应症(其中7项为附条件批准,2项为完全批准),1款干细胞疗法通过附条件批准上市,1款基因疗法获得完全批准。
其中,5款CAR-T细胞治疗产品基于单臂临床试验在中国获批上市。这些试验以经CAR-T细胞疗法治疗至少三个月的肿瘤应答情况为主要研究终点,符合CDE评估疗效持久性的要求。所有产品均表现出良好的获益-风险特征,疗效数据显著优于现有疗法。不过,这些研究的样本量有限,企业必须开展上市后临床研究以进⼀步验证产品的有效性和安全性。附条件批准的产品应从批准之日起在规定的时间内完成验证性临床试验,时限最长为四年。此外,企业必须对接受CAR-T细胞疗法治疗的患者进行长期随访,并收集真实世界研究数据。
⼀款率先在海外获批上市的CAR-T产品 阿基仑赛,基于桥接研究和海外临床研究数据在中国获批上市。桥接研究的主要终点与海外临床研究一致。未来同类产品的上市申请,海外临床研究数据是否有效仍然需要与CDE进行沟通。
中国CAR-T细胞疗法上市后风险的特点是围绕产品全生命周期进行全面管控,严格保障患者安全并确保治疗效果,尤其注意监测继发性(如T细胞)的出现。国际研究已经报道了有少数病例在恶性T细胞克隆中检测到CAR转基因的出现,但中国尚未见报告患者在治疗后发生继发性T。在临床实践中,风险控制措施在整个药物开发过程和商业化流程中贯穿始终。临床试验文件强调密切监测继发性恶性肿瘤风险;产品说明书中明确警告此类风险,并且要求终生随访患者;并且,标准化方案已建立,治疗前和治疗后均会及时收集生物样本,以便发现恶性事件时进行分子分析。
中国CGT药物的监管格局正在迅速演变,以满足日益增长的对先进治疗药物(ATMP)的需求。CDE已初步提出了中国ATMP的分类与描述体系,并正在研究加速其开发的政策。药品监管改革正在深化,在今年1月初发布的53号文件[3]中,国务院提出了 提前介入、⼀企⼀策、全程指导、研审联动 的要求,加强新药开发全过程的沟通交流,全力推动新药的高质量开发加速。CDE可能会采取逐案审查的方式,根据不同产品的具体风险、获益和生产复杂性制定相应的策略。随着CGT领域的快速发展,中国将不断完善其监管架构以支持创新。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 【MADI·美械会】日程抢先看!免费门票限时领!评审中心 / 研发企业 / 临床机构齐聚苏州! (2025-10-16)
- 人类皮肤可以产生卵子?!最新Nature子刊:科学家成功将人体皮肤细胞的染色体“减半”,制造出类卵细胞结构 (2025-10-16)
- 面对输赢,男性赢了还想赢,女性赢了却偏向“见好就收”?最新Neuron|原来都是大脑PV神经元在暗中操控! (2025-10-16)
- 《柳叶刀》子刊:戒烟对认知有重要意义!最长18年随访研究显示,戒烟者的长期认知轨迹较吸烟者更好 (2025-10-16)
- 破局之“法”!通过重构宫颈癌供血系统,法米替尼“一箭双雕”,既直接抗癌又协同增效免疫治疗 (2025-10-16)
- Nature Biotechnology:基因“静音”的艺术?不“剪”基因,我们如何实现精准长效的疾病调控 (2025-10-15)
- Cell重磅:人类胚胎干细胞来源的多巴胺能前体细胞,安全有效治疗帕金森病 (2025-10-15)
- Nature:酶功能研究的下一个“利器”!EZSpecificity模型如何重定义酶功能预测的精度边界? (2025-10-15)
- 猪鼻里藏着“抗病毒卫士”!南京农大发现枯草芽孢杆菌 NS12,广谱阻击呼吸道病毒还不易耐药 (2025-10-14)
- Research:肝纤维化有救了?中药成分发现“双面杀手” 精准清除致病细胞 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















