CAR-T细胞疗法研究进展(第51期) |
 |
(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性和非霍奇金的治疗上有着显著的疗效,被认为是最有前景的方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.
DOI: 10.1126/sciadv.adv4937
在实体瘤治疗领域,CAR-T 细胞疗法却一直面临着重重挑战。实体瘤内部结构复杂,周围有一道类似 铜墙铁壁 的物理屏障,使得 CAR-T 细胞很难渗透进去。而且,肿瘤细胞十分狡猾,它们表面的抗原表达水平各不相同,还会通过各种手段躲避 CAR-T 细胞的追杀,比如改变自身抗原,让 CAR-T 细胞 找不到北 。传统的 CAR-T 细胞疗法,就像一把只能开一把锁的钥匙,CAR 固定识别一种抗原,一旦肿瘤抗原发生变化,它就难以发挥作用了。不仅如此,这种疗法还有个致命弱点,就是容易产生严重的毒副作用,有时甚至会对患者身体造成极大伤害。
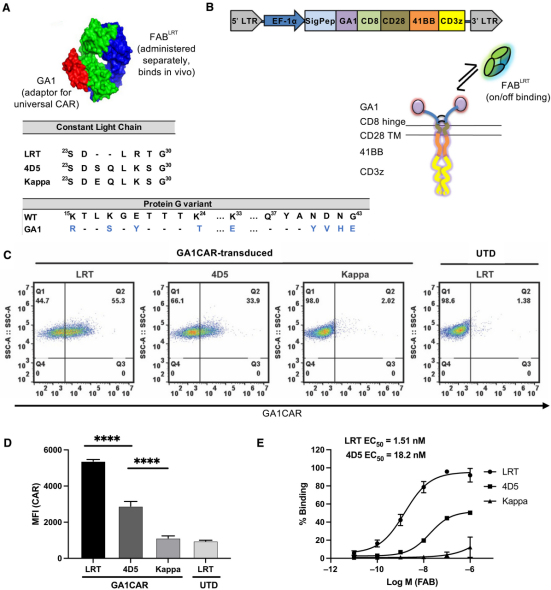
为了突破这些困境,来自芝加哥大学的科研团队另辟蹊径,开发出了一种具有变革意义的 通用型 嵌合抗原受体(CAR)平台 GA1CAR,相关研究成果发表在《科学进展》(Science Advances)杂志上。这个全新的 CAR-T 细胞疗法,犹如给癌症治疗领域带来了一场 及时雨 ,有望改写癌症治疗的格局。
GA1CAR 平台的设计堪称精妙绝伦,它创新性地将抗原识别元件与 CAR-T 细胞内的信号传导机制分离开来,采用了一种模块化 分离式 设计。在这个系统里,工程化蛋白 G 变体(GA1)与 T 细胞受体的信号传导结构域紧密融合在一起,就像是一个随时待命的 战斗核心 。
而负责识别肿瘤靶标的部分,则由短效抗体片段(Fab 片段)来承担,这些 Fab 片段就像是一个个的 探测器 ,它们经过特殊的工程化设计,能够特异性地靶向 CAR-T 细胞表面的 GA1 组分,与 GA1 形成强大但可逆的连接,并且它们在人体血液中的循环半衰期大约只有两天。当没有 Fab 片段 指挥 时,GA1CAR-T 细胞就处于 休眠 状态,不会随意发动攻击,避免了对正常细胞的误杀。
这种 即插即用 的设计,赋予了 GA1CAR-T 细胞疗法极高的灵活性和安全性。就如同论文共同通讯作者、芝加哥大学生物化学与分子生物学系教授 Anthony Kossiakoff 博士所说: 这个新型 CAR-T 系统就如同一个即插即用的设备。通过简单地更换抗体片段(Fab),我们能够让相同的 CAR-T 细胞以更高的安全性和灵活性,去攻击不同的癌症靶标。 临床医生可以根据患者肿瘤的具体情况,随时调整 Fab 片段,让 CAR-T 细胞精准打击,就像为每一位患者量身定制了一把 抗癌利刃 。
2.
doi:10.1186/s12943-025-02371-1
在癌症治疗领域,CAR-T 细胞疗法无疑是一颗耀眼的 明星 。作为革命性的免疫治疗手段,它在血液系统(如淋巴瘤、白血病)中创造了诸多 治愈 奇迹 部分患者在接受治疗后实现长期缓解,甚至临床治愈。然而,这一疗法并非完美无缺:尽管初始反应率可高达 70% 以上,但超过 60% 的患者会在 1-2 年内复发,长期缓解率仅维持在 30%-40%。全球每年新增数十万血液系统恶性,如何突破 CAR-T 疗法的 持久性瓶颈 ,成为医学界亟待解决的关键问题。
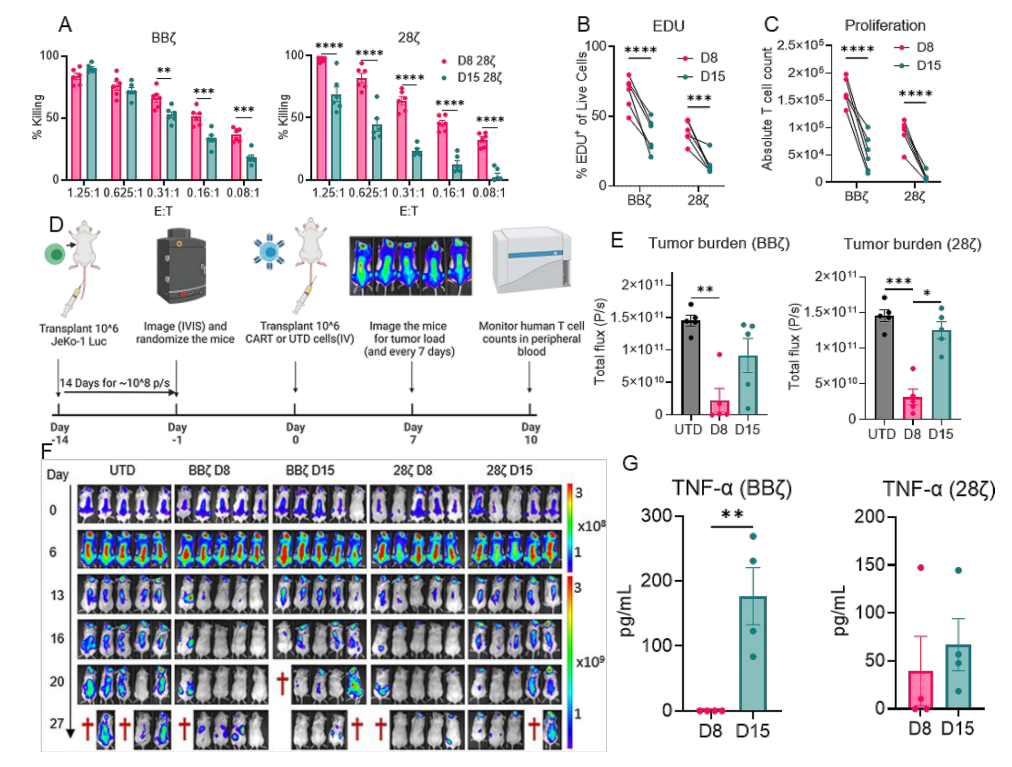
近日,发表在《Molecular Cancer》杂志上的一项研究为这一难题带来了新答案。来自梅奥诊所等机构的科学家团队发现:细胞衰老或许是 CAR-T 疗法失败的 隐形杀手 ,而 CAR-T 细胞中 共刺激域 的差异,直接决定了其是否容易陷入衰老状态 这一发现为优化 CAR-T 疗法、延长疗效持久性开辟了全新路径。
CAR-T 细胞疗法的核心是对患者自身 T 细胞进行基因改造,使其表达 嵌合抗原受体(CAR) ,从而精准识别并杀伤癌细胞。而 CAR 结构中的 共刺激域 ,相当于 T 细胞的 加速器 ,负责调控其激活、增殖和存活能力。目前临床常用的 CAR-T 细胞主要搭载两种共刺激域:4-1BB-CD3 (简称 BB )和 CD28-CD3 (简称 28 )。
过去的研究认为,BB 和 28 的差异主要体现在 活性持续时间 上:BB 激活较温和但持久,28 初始激活强烈但持续时间短。而这项新研究则揭示了更关键的区别:面对反复激活(模拟体内与癌细胞的持续 战斗 ),两种 CAR-T 细胞的 衰老抵抗力 截然不同。
3.
DOI: 10.1016/j.cell.2025.05.038
系统性硬化症(systemic sclerosis)通过免疫系统异常反应、微塌陷和胶原蛋白失控而逐渐使组织窒息,且对传统免疫抑制剂、生物制剂及抗纤维化药物均呈现耐药性,同时导致10年死亡率高达40%。
基于细胞的治疗方法,如移植和CAR-T细胞疗法,虽显示出潜力,但存在高毒性或需要耗时费力的定制生产,这使得临床医生和患者仍在寻求更安全、更易获取的治疗工具。
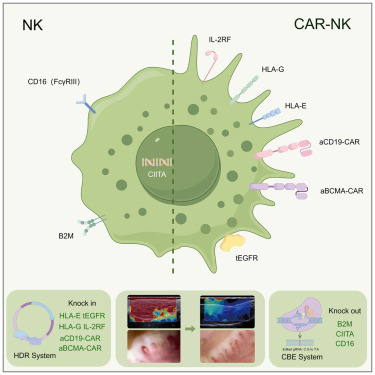
在一项新的研究中,来自中国人民解放军海军军医大学长征医院等研究机构的研究人员开发出一种基于诱导性多能干细胞(iPSCs)的现成细胞疗法:QN-139b,成功缓解了一名36岁严重弥漫性皮肤型系统性硬化症女性患者的致命性皮肤和器官瘢痕。相关研究结果发表于《细胞》杂志。
研究人员通过基因编辑人类iPSCs,敲除B2M、CIITA和CD16基因,同时插入HLA-E、HLA-G、白细胞介素-2受体融合蛋白(IL-2RF)、截短型表皮生长因子受体(tEGFR)以及靶向CD19和BCMA的双顺反子嵌合抗原受体(CAR)。
这些经过基因修饰的人类iPSCs被分化为自然杀伤细胞系并扩增。通过(300 mg/m )和氟达拉滨(25 mg/m )连续三天治疗实现淋巴细胞耗竭。在第0、3、7和10天分别6 10⁸个QN-139b细胞。
4.
DOI:10.1126/scitranslmed.ado9511
胶质母细胞瘤(GBM,Glioblastoma)是系统最常见、最致命的原发性恶性肿瘤,素有 之王 之称。尽管现代医学不断进步,但胶质母细胞瘤患者的中位生存期仍仅为12-15个月,5年生存率不足5%;更令人沮丧的是,这种肿瘤极易复发,且对传统的手术、放疗和化疗均不敏感。近年来,CAR-T细胞疗法在血液肿瘤中取得了革命性突破,但在实体瘤领域却屡屡受挫。实体瘤的免疫抑制性微环境(TME)如同一道 铜墙铁壁 让CAR-T细胞难以渗透、存活和发挥杀伤作用。如何破解这一难题,成为全球科学家关注的焦点。

近日,一篇发表在国际杂志Science Translational Medicine上题为 A cross-talk established by tumor-targeted cytokines rescues CAR T cell activity and engages host T cells against glioblastoma in mice 的研究报告中,来自意大利圣拉斐尔-泰莱顿基因治疗研究所(SR-TIGET)等机构的科学家们通过研究巧妙地利用基因疗法将肿瘤相关巨噬细胞(TEMs)改造成 特洛伊木马 ,并在肿瘤局部释放免疫刺激因子从而成功激活CAR-T细胞,进而就能显著抑制胶质母细胞瘤的生长,延长小鼠的生存期。
文章中,研究者利用基因工程技术对一种名为TIE2表达的肿瘤相关巨噬细胞(TEMs)进行改造,使其在肿瘤微环境中特异性地释放两种关键的免疫刺激因子:干扰素- (IFN- )和一种工程化的白细胞介素-2(oIL-2)。IFN- 是一种多效性免疫激活剂,其能对抗肿瘤局部的免疫抑制信号从而增强抗原提呈和免疫效应细胞的活性;而oIL-2则是一种 私人定制 的细胞因子,其只能激活与CAR-T细胞共同引入的特定突变受体从而特异性地促进CAR-T细胞的增殖和活性并能避免全身性毒性。这种 私人对话 机制就能确保免疫刺激因子只在肿瘤局部发挥作用,从而精准地增强CAR-T细胞的战斗力同时避免了对正常组织的损伤。
5.
doi:10.1186/s13045-025-01715-0
与B细胞恶性肿瘤相比,T-ALL的免疫治疗进展缓慢,由于恶性T细胞与健康T细胞在表面抗原表达上高度相似,传统的CAR-T细胞疗法面临 自相残杀 (fratricide)和T细胞发育不全(T cell aplasia)等致命问题。近年来,研究者尝试通过基因编辑技术敲除CD7等泛T抗原,尽管取得了一定进展,但技术复杂、监管难度大,且仍需依赖alloHSCT进行挽救治疗,因此寻找安全、特异、非泛T抗原的靶点成为T-ALL免疫治疗的关键突破口。
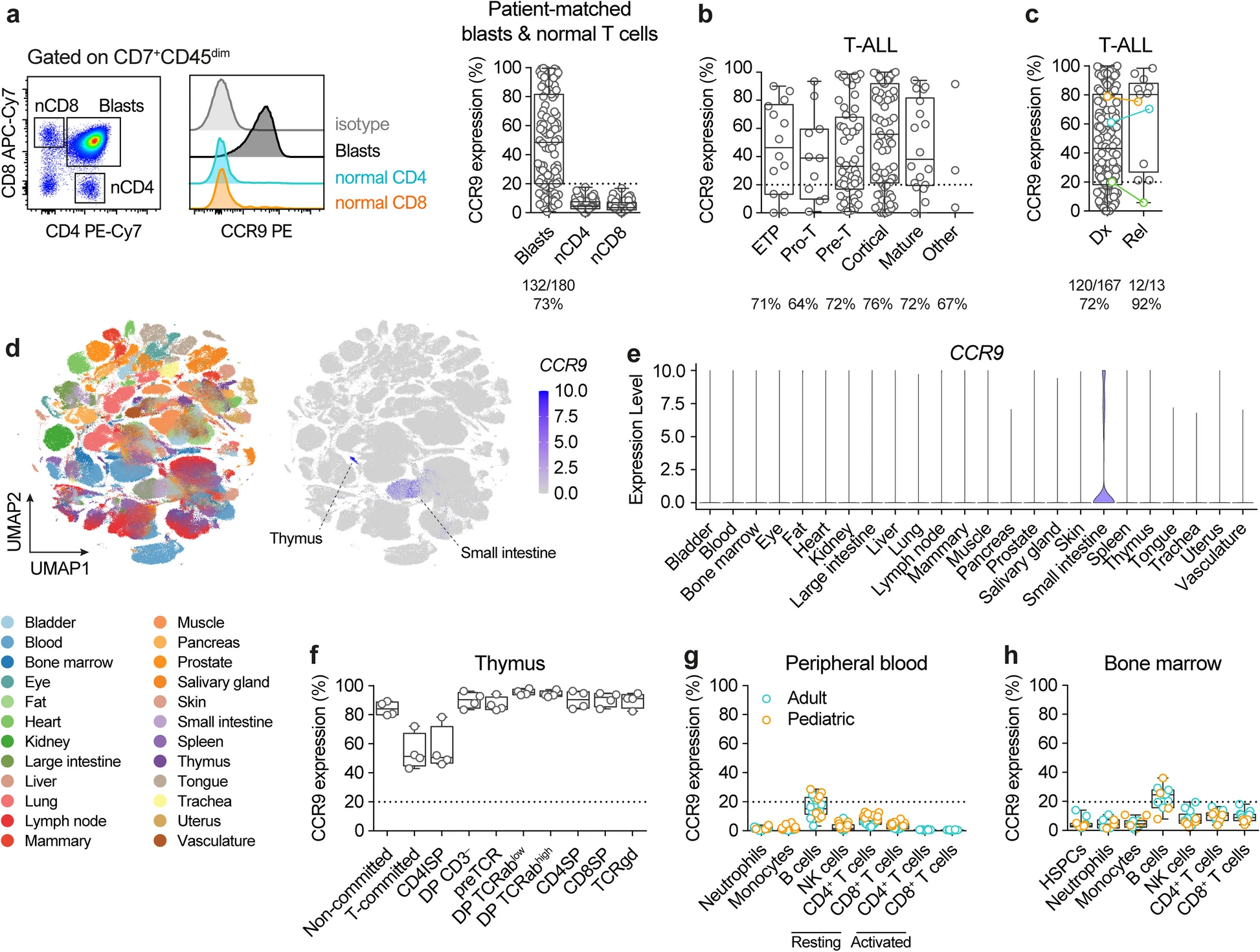
近日,一篇发表在国际杂志Journal of Hematology Oncology上题为 CAR-T cells targeting CCR9 and CD1a for the treatment of T cell acute lymphoblastic leukemia 的研究报告中,来自西班牙何塞普-卡雷拉斯白血病研究所等机构的科学家们通过研究聚焦于两个非泛T抗原 CCR9和CD1a,同时开发并验证了一种双靶点CAR-T细胞治疗策略,旨在克服T-ALL治疗中的抗原逃逸、制造困难和免疫毒性等问题,相关研究或具有重要的临床转化价值。
文章中,研究人员首先对180例T-ALL患者样本进行免疫表型分析,结果发现CCR9在73%的患者中高表达,尤其在复发样本中表达率高达92%。更重要的是,CCR9在正常T细胞、造血干细胞及其他组织中几乎不表达,仅在部分胸腺细胞和肠道淋巴细胞中微弱表达,具备良好的安全性。CD1a则主要在皮质型T-ALL中表达,约占所有T-ALL的30%。两者联合可覆盖86%的患者并能显著扩大治疗人群。
在实验设计上,研究者采用杂交瘤技术筛选出高亲和力的CCR9单克隆抗体,并构建出鼠源和人源化的单链抗体(scFv),进一步将其嵌入第二代CAR结构中,构建出了三种CCR9-CAR-T细胞(鼠源M、人源化H1和H2)。通过体外细胞毒性实验发现,H2型CAR-T细胞在杀伤CCR9阳性T-ALL细胞系(如MOLT4)和患者来源异种移植模型(PDX)中表现出最强的活性和特异性,且无明显自相残杀现象。
6.
DOI: 10.1126/science.ads8473
CAR-T 细胞疗法在 B 症及、肌炎、白血病等 B 细胞驱动的自身免疫性疾病治疗中已实现持久缓解。然而,因依赖昂贵个性化实验室流程且仅少数专业中心提供,美国超 2000 万自身免疫病患者无法获得该治疗。
卡普斯坦治疗公司(Capstan Therapeutics)研究人员带来新希望 证实脂质纳米颗粒(tLNPs)可在体内对 CAR-T 细胞进行基因改造,无需实验室细胞制造和体外扩增。相关研究发表于《科学》杂志。
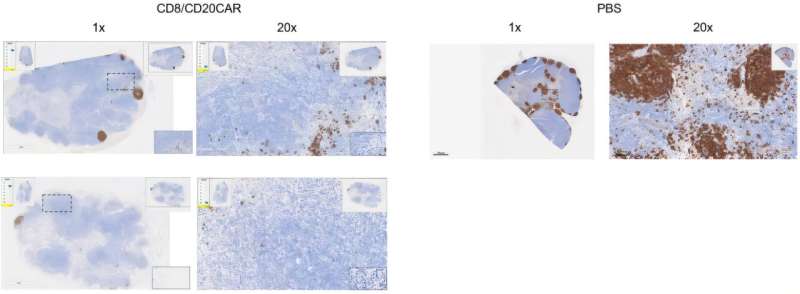
研究人员开发的脂质纳米颗粒药物,一次制备后可适用于多名患者,无需针对每名患者定制基因载荷,降低成本与专业中心依赖。实验涵盖人源化小鼠、原代人类免疫细胞及 22 只恒河猴,后者接受三剂治疗性纳米颗粒 L829(0.1 2.0 mg/kg)。
另有 15 只恒河猴测试两剂方案,4 只接受糖皮质激素 - 抗组胺药预处理。通过药代动力学、流式细胞术等手段监测 CAR 表达、B 细胞计数等指标。结果显示,与 mRNA 疫苗基准脂质相比,L829 在肝脏脱靶表达减少,脾脏和淋巴组织积累增强,且优先修饰 CD8+ T 细胞。CAR 表达 6 小时内可检测到,72 小时内下降。这些在体内基因改造的 CAR-T 细胞具备抗原特异性细胞毒性等功能,体外可有效清除 CD19+ 靶细胞。
在人源化小鼠中,单次静脉注射 10 g 或 30 g CD8-L829-tLNP-CD19 可在 3 小时内诱导近乎完全的 B 细胞耗竭,24 小时后 CAR 表达仍可检测。携带 Nalm6 白血病的小鼠接受 30 g 剂量后,五只中的四只在首剂后两天内近乎完全清除肿瘤,第二剂后第三天全部清除。
7.
DOI:10.1136/jitc-2024-009825
在抗癌领域,CAR-T细胞疗法如同一把锐利的剑,已经成功斩断了血液肿瘤的魔爪,然而,面对更为复杂的实体瘤,这把剑似乎失去了往日的锋芒。近年来,科学家们对实体瘤治疗新方法的探讨如火如荼,同时他们也在不断探索新的靶点和优化策略旨在让CAR-T细胞疗法在实体瘤治疗中大放异彩。
近日,一篇发表在国际杂志Journal for ImmunoTherapy of Cancer上题为 Development and optimization of Eva1 (MPZL2) targeting chimeric antigen receptor T cells 的研究报告中,来自名古屋大学医学院等机构的科学家们通过研究为实体瘤的CAR-T细胞治疗带来了新的曙光,文章中,研究人员成功开发了靶向Eva1(MPZL2)的CAR-T细胞,并在多种实体瘤模型中展示了其显著的治疗效果,这一发现无疑为实体瘤患者带来了新的希望。
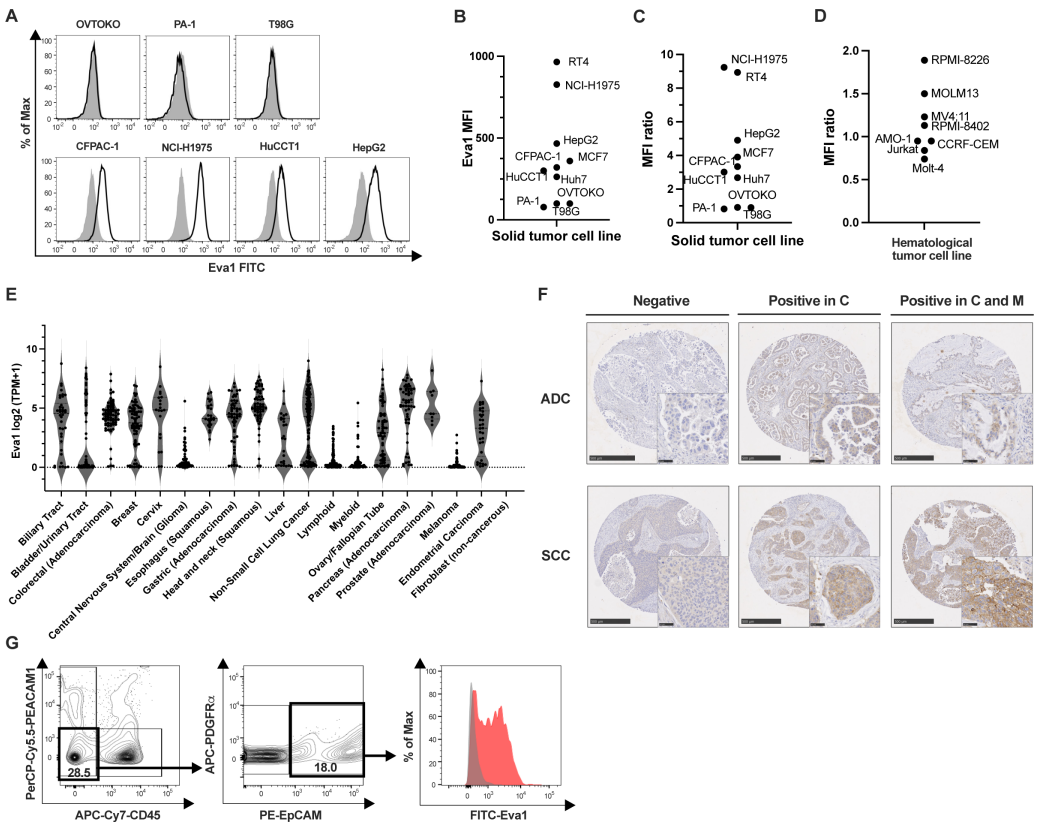
文章中,研究人员首次将Eva1作为CAR-T细胞疗法的靶点并成功展示了其在实体瘤治疗中的潜力。Eva1是一种在多种实体瘤中高度表达的蛋白,但在正常组织中表达较低,这使得其成为CAR-T细胞疗法的理想靶点,研究者通过开发靶向Eva1的CAR-T细胞为实体瘤患者提供一种新的、有效的治疗手段。
研究中的实验对象包括多种人源肿瘤细胞系、异种移植小鼠模型以及健康志愿者的外周血单核细胞(PBMC),研究人员采用了基因工程技术构建人源化Eva1 CAR-T细胞,并利用流式细胞术、免疫组化、生物发光成像(BLI)等技术对CAR-T细胞的特异性、增殖能力、细胞因子分泌及体内外抗肿瘤效果进行了全面评估。
8.
DOI:10.1200/JCO-25-00760
在医学研究领域,癌症治疗一直是科研人员和临床医生关注的焦点,近年来,作为一种新兴的免疫治疗方法,CAR-T细胞疗法为癌症患者带来了新的希望。多发性骨髓瘤(MM, Multiple Myeloma)是一种常见的血液系统恶性肿瘤,传统治疗方法的效果有限,患者的预后通常不佳;然而随着CAR-T细胞疗法的发展,特别是针对B细胞成熟抗原(BCMA)的西达基奥仑赛(cilta-cel,Ciltacabtagene Autoleucel)的应用,为多发性骨髓瘤患者带来了新的曙光。
近日,一篇发表在国际杂志Journal of Clinical Oncology上题为 Long-Term ( 5-Year) Remission and Survival After Treatment With Ciltacabtagene Autoleucel in CARTITUDE-1 Patients With Relapsed/Refractory Multiple Myeloma 的研究报告中,来自西奈山伊坎医学院等机构的科学家们进行了一项关于cilta-cel治疗复发/难治性多发性骨髓瘤(Relapsed/Refractory Multiple Myeloma, RRMM)的长期( 5年)缓解和生存的研究,并通过研究揭示了其在临床应用中的潜力和意义。
本文研究旨在评估西达基奥仑赛疗法(cilta-cel)在治疗复发/难治性多发性骨髓瘤(RRMM)患者中的长期疗效和安全性;以往的研究已经证明cilta-cel在RRMM患者中具有显著的疗效,但长期随访数据有限,本文研究通过长期随访探讨了西达基奥仑赛治疗后患者是否能够实现长期缓解,甚至达到潜在的治愈效果。
这项研究中,研究人员共纳入了97名接受西达基奥仑赛治疗的RRMM患者,这些患者在2018年7月至2019年10月期间接受了治疗,研究的中位随访时间为61.3个月,其中32名患者(33%)在治疗后 5年仍保持无进展生存(PFS)且无需进一步治疗。研究中使用的技术包括流式细胞术评估免疫细胞表型及通过Meso Scale Discovery技术检测血清生物标志物。此外,研究人员还通过正电子发射断层扫描-计算机断层扫描(PET-CT)评估患者的最小残留病(MRD)状态。(100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 【MADI·美械会】日程抢先看!免费门票限时领!评审中心 / 研发企业 / 临床机构齐聚苏州! (2025-10-16)
- 人类皮肤可以产生卵子?!最新Nature子刊:科学家成功将人体皮肤细胞的染色体“减半”,制造出类卵细胞结构 (2025-10-16)
- 面对输赢,男性赢了还想赢,女性赢了却偏向“见好就收”?最新Neuron|原来都是大脑PV神经元在暗中操控! (2025-10-16)
- 《柳叶刀》子刊:戒烟对认知有重要意义!最长18年随访研究显示,戒烟者的长期认知轨迹较吸烟者更好 (2025-10-16)
- 破局之“法”!通过重构宫颈癌供血系统,法米替尼“一箭双雕”,既直接抗癌又协同增效免疫治疗 (2025-10-16)
- Nature Biotechnology:基因“静音”的艺术?不“剪”基因,我们如何实现精准长效的疾病调控 (2025-10-15)
- Cell重磅:人类胚胎干细胞来源的多巴胺能前体细胞,安全有效治疗帕金森病 (2025-10-15)
- Nature:酶功能研究的下一个“利器”!EZSpecificity模型如何重定义酶功能预测的精度边界? (2025-10-15)
- 猪鼻里藏着“抗病毒卫士”!南京农大发现枯草芽孢杆菌 NS12,广谱阻击呼吸道病毒还不易耐药 (2025-10-14)
- Research:肝纤维化有救了?中药成分发现“双面杀手” 精准清除致病细胞 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















