科学家们在人类阿尔兹海默病研究领域取得的新进展! |
 |
病是全球最常见的神经退行性疾病之一,其发病率随着人口老龄化而不断增加,据WHO数据显示,全球约有5000万阿尔兹海默病患者,预计到2050年这一数字将会翻倍。阿尔兹海默病的特征性病理变化包括脑内淀粉样斑块(A )的沉积和神经原纤维缠结(tau蛋白过度磷酸化)。
本文中,小编对近期科学家们在人类阿尔兹海默病研究领域取得的新成果进行整理,分享给大家!
【1】
doi:10.1126/scitranslmed.adu2459
?肺癌,这个全球癌症死亡的 头号杀手 ,严重威胁着人类健康。其中,()最为常见,约占所有肺癌病例的 85%。更糟糕的是,约 40% 的 NSCLC 患者最终会发生脑转移。一旦癌症转移至大脑,患者的生存期将大幅缩短,也会急剧下降。当前,针对肺癌脑转移的有效治疗手段极为有限,无论是患者还是医疗工作者,都急切期盼着新的治疗突破。
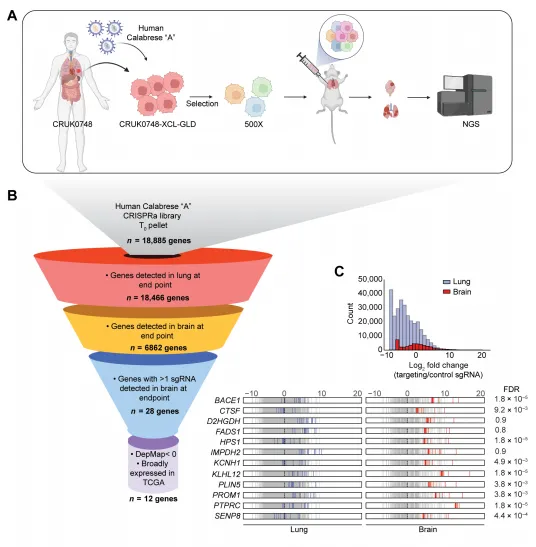
体内CRISPR激活筛选鉴定出BACE 1驱动LUAD-BBM
近期,一项发表于国际权威杂志Science Translational Medicine上题为 A genome-wide in vivo CRISPR activation screen identifies BACE1 as a therapeutic vulnerability of lung cancer brain metastasis 的研究成果,给肺癌脑转移的治疗带来了新希望。来自麦克马斯特大学等机构的科研团队发现,一种长期以来与阿尔兹海默病(即 老年痴呆 )紧密相关的蛋白 BACE1,竟是肺转移至大脑的关键 帮凶 。令人惊喜的是,一种原本用于治疗阿尔兹海默病的药物,有望被重新开发,成为阻止肺癌脑转移的有力武器。
BACE1,全称 - 分泌酶 1(beta - secretase 1),在阿尔兹海默病研究领域可谓 声名狼藉 。它能够切割 APP 蛋白,产生 - 淀粉样蛋白。这些蛋白在大脑中异常聚集,形成标志性的 老年斑 ,被认为是导致神经元死亡和认知功能衰退的重要因素。因此,多年来科学家们一直致力于研发抑制 BACE1 的药物,期望能够攻克阿尔兹海默病。
【2】
doi:10.1038/s41586-025-09202-9等
提到蓝色小药片 伟哥 (西地那非),大多数人会露出心领神会的微笑,第一反应都是它那些 不可描述 的功效。但最近,科学家们发现,这款 男性福音 可能要解锁一个让人意想不到的新技能,那就是「帮助系统对抗肿瘤」!众所周知, 伟哥 是一种治疗男性勃起障碍的药物。但实际上,它最初被生产出来,是用于治疗心脏疾病的。而近日,它的用途得到了进一步的扩展。
西湖大学相关研究团队在Nature杂志上发表了一项重要研究成果。该研究首次揭示了关键的抗原呈递细胞 树突状细胞(DCs),它们从肿瘤向肿瘤引流淋巴结(tdLNs)迁移的能力会随着肿瘤的进展而逐步受到抑制。这种抑制作用削弱了树突状细胞对肿瘤特异性 T 细胞的致敏功能,进而导致进入肿瘤微环境的 T 细胞数量减少,最终引发免疫逃逸现象。然而,破解这一不利影响的关键在于我们熟知的 蓝色小药片 也就是西地那非,俗称 伟哥 。
从更通俗的角度来讲,我们身体内部存在着一支高度精密的 抗癌部队 。在其中,DCs 扮演着至关重要的 侦察兵 角色。但在肿瘤不断发展的过程中,DCs会逐渐 走着走着,忘了自己要去哪、要干嘛 。这使得本应迅速赶来消灭肿瘤的 T 细胞大军无法及时获取准确的情报,从而为肿瘤的壮大提供了可乘之机。而咱 伟哥 的出现则宛如为 DCs 安装了一套的 GPS 导航系统,帮助它们重新校准方向,能够准确无误地向免疫系统传递肿瘤相关敌情!这样一来,免疫大军便能更精准地锁定肿瘤目标,并发起更为有效的攻击。
【3】
doi:10.1172/JCI180826
在探索阿尔兹海默病(AD,Alzheimer s disease)治疗的漫长征途中,科学家们一直在寻找能缓解这一神经退行性疾病症状的新方法。日前,一篇发表在国际杂志Journal of Clinical Investigation上题为 The gut microbiome controls reactive astrocytosis during A amyloidosis via propionate-mediated regulation of IL-17 的研究报告中,来自美国西北大学等机构的科学家们通过研究揭示了一种来自肠道的化合物 丙酸或会对缓解阿尔兹海默病的症状具有潜在的治疗效果。

阿尔兹海默病是中最常见的形式,目前影响着超过600万美国人,随着人口老龄化,这一数字预计还将大幅上升。近年来,越来越多的证据表明,肠道微生物组(GMB)可能在阿尔兹海默病的发病机制和进展中起着重要作用。然而,肠道微生物组如何影响大脑中的炎症反应和淀粉样斑块的积累,其具体机制尚不清楚。
在这项开创性的研究中,科学家们首先对接受治疗的小鼠进行了代谢组学分析,结果发现,只有雄性小鼠的血浆中丙酸水平显著增加。丙酸是一种由肠道中某些细菌产生的短链脂肪酸。为了进一步验证丙酸的作用,研究人员向阿尔兹海默病模型小鼠的饮用水中添加丙酸,发现这能减少小鼠机体中反应性星形胶质细胞和淀粉样斑块的水平。这表明,丙酸或能通过调节肠道微生物组来影响大脑中的炎症反应和淀粉样斑块的积累。
【4】
doi:10.1038/s41591-025-03574-1
在对抗(AD)的漫长征途中,科学家们已经奋斗了三十多年。这种疾病以其对患者记忆和认知功能的无情侵蚀而闻名,而其背后的 罪魁祸首 之一就是大脑中积累的淀粉样 蛋白(A )斑块,这些斑块如同大脑中的 垃圾堆 阻碍着神经细胞的正常功能,进而引发了一系列认知障碍。多年来,研究者们一直试图通过清除这些斑块来治疗阿尔茨海默病,然而这一策略的效果并不理想,甚至在某些情况下还引发了严重的副作用。
近日,一篇发表在国际杂志Nature Medicine上题为 Microglial mechanisms drive amyloid- clearance in immunized patients with Alzheimer s disease 的研究报告中,来自美国西北大学Feinberg医学院等机构的科学家们通过研究提出了一种全新的治疗思路,即通过增强大脑自身的免疫细胞来更有效地清除这些有害的斑块。
这项研究中,研究人员首次采用了尖端技术 空间转录组学(Spatial Transcriptomics)对参与阿尔茨海默病临床试验的人类大脑样本进行了深入分析。通过这项技术,科学家们就能精确地定位大脑组织样本中基因活动的具体空间位置,研究人员分析了接受淀粉样 蛋白免疫治疗的阿尔茨海默病患者捐赠的大脑组织,并将其与未接受治疗的患者的大脑组织进行了比较。结果表明,当治疗有效时,大脑中的免疫细胞(称为小胶质细胞)不仅能够清除斑块,还能帮助恢复大脑的健康环境。这一发现有望彻底改变阿尔茨海默病治疗的未来,将研究重点从单纯地清除斑块转移到利用大脑的自然防御机制上来。此前,阿尔茨海默病疫苗的尝试因免疫系统反应导致危险的大脑肿胀而失败。即使是目前批准的抗体治疗也存在争议,其只能提供有限的益处,并且可能伴有副作用和高昂的价格。
【5】
doi:10.1186/s40478-025-01935-y
病理性的tau蛋白亚型包括丝氨酸396位点的过度磷酸化tau(pS396-tau)和tau寡聚体(Oligo-tau),其在阿尔兹海默病和阿尔兹海默病痴呆症所引起的轻度认知损伤患者机体视网膜中的水平会升高,这些患者会表现出明显的视网膜神经节细胞(RGC,retinal ganglion cell)的丧失,然而,视网膜神经节细胞中tau蛋白亚型的存在以及对视网膜神经节细胞完整性的影响(尤其是在早期阿尔兹海默病中),目前研究人员并未充分研究。
近日,一篇发表在国际杂志Acta Neuropathologica Communications上题为 Retinal ganglion cell vulnerability to pathogenic tau in Alzheimer s disease 的研究报告中,来自西达赛奈医学中心等机构的科学家们通过研究发现,在阿尔兹海默病患者大脑积累的一种异常形式的tau蛋白或许也会在阿尔兹海默病患者的眼睛中积累。
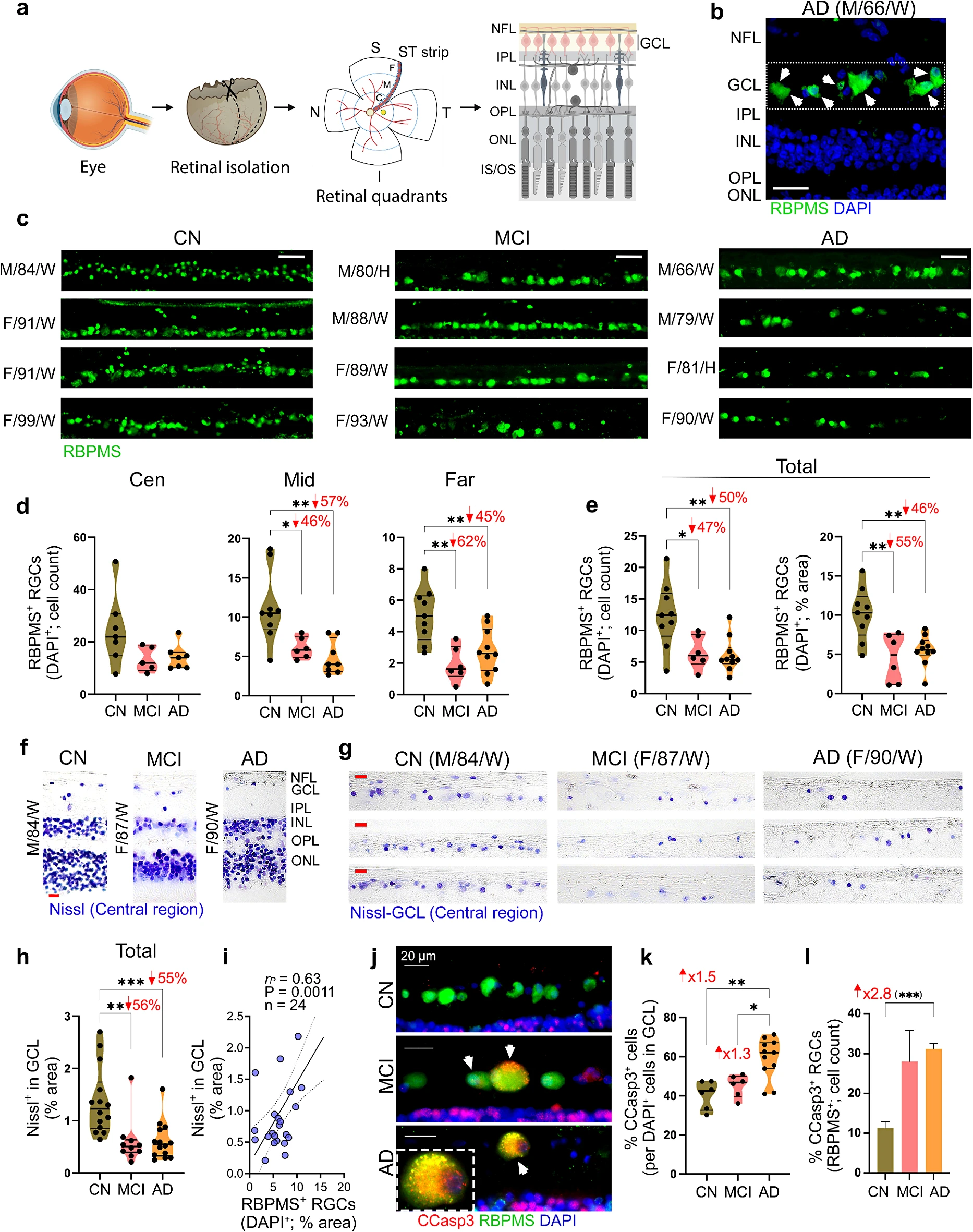
轻度认知损伤和阿尔兹海默病患者机体视网膜组织中神经节细胞的完整性
本文中,研究人员首次提供证据表明,异常的tau蛋白会在阿尔兹海默病患者眼睛中的特殊神经细胞中积累,同时研究者还将这种积累与大脑功能的恶化联系了起来。Maya Koronyo-Hamaoui教授说道,我们发现,异常的tau蛋白会在视网膜神经节细胞中积累,而视网膜神经节细胞是眼睛向大脑中发送信息的关键神经细胞。同时研究人员还发现,在患有轻度认知功能损伤和阿尔兹海默病症状的患者中,异常tau蛋白的早期积累与其机体视网膜神经节细胞的死亡存在一定的关联。
【6】
doi:10.1002/alz.14592
阿尔兹海默病(AD,Alzheimer s disease)是一种最常见的人类痴呆症,尽管如今科学家们已经识别出了很多阿尔兹海默病相关的遗传决定因素,但很少有研究分析非欧洲裔的人群。
近日,一篇发表在国际杂志Alzheimer s Dementia上题为 Identification of 16 novel Alzheimer s disease loci using multi-ancestry meta-analyses 的研究报告中,来自麻省总医院等机构的科学家们通过研究对阿尔兹海默病进行了一项多祖先、全基因组测序关联性研究,结果发现了16个新型阿尔兹海默病易感基因的证据,从而就扩大了对阿尔兹海默病在代表性不足群体中的研究。
文章中,研究者Julian Daniel Sunday Willett博士等人通过联合研究,利用全基因组测序和49,149名个体组成的队列进行研究,该研究共纳入了12,074名在临床上为阿尔兹海默病的参与者和37,075名有阿尔兹海默病家族史的个体进行分析。参与者来自多个公共数据库,有近一半都是非欧洲裔血统,研究人员发现了16个新型的阿尔兹海默病相关遗传信号,这就强调了研究不同人群的重要性。
【7】
doi:10.1093/brain/awae339
衰老是大脑功能衰退的基础,其也是包括阿尔兹海默病在内的人类多种神经变性疾病发生的主要风险因素,然而,在衰老过程中引起大脑功能下降以及如何促进阿尔兹海默病的发病背后的分子机制,研究人员并不清楚。近日,一篇发表在国际杂志Brain上题为 Human longevity and Alzheimer s disease variants act via microglia and oligodendrocyte gene networks 的研究报告中,来自英国伦敦大学学院等机构的科学家们通过研究发现,遗传差异会影响一个人的寿命以及其患阿尔兹海默病的风险。
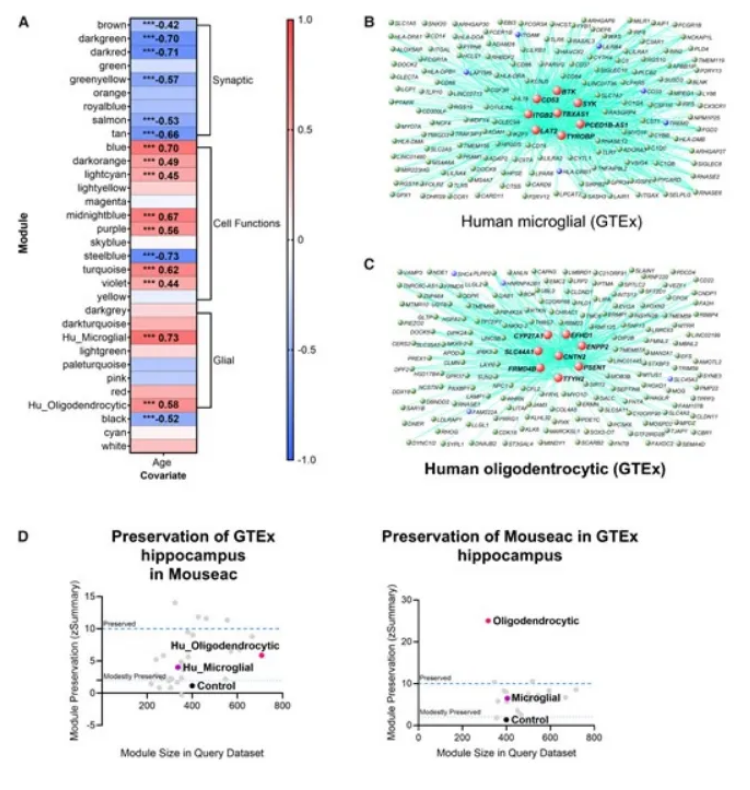
人类海马体的共表达分析揭示了小鼠或人类特有的衰老方面和特征
文章中,研究者发现,大脑细胞(尤其是大脑中称之为小胶质细胞的免疫细胞和支持神经细胞的少突胶质细胞)中的遗传突变与机体衰老和阿尔兹海默病发生直接相关;这一研究发现或能帮助识别出治疗阿尔兹海默病的潜在新型靶点,并有望深入理解机体大脑衰老的原因。研究者Dervis Salih博士说道,我们的研究强调了某些脑细胞的遗传变异是如何为药物发现新的分子治疗靶点提供机会的;通过理解这些细胞随着年龄的增长而改变,以及其在阿尔兹海默病中的作用,我们对大脑的衰老有了更为深入的了解,也为开发创新性和预防性的疗法提供了希望,并能为遭受这种疾病影响的家庭带来更光明的未来。
为了理解机体衰老和阿尔兹海默病发生背后的遗传因素,研究人员利用了大型遗传信息数据集中的数据,包括来自国际阿尔兹海默病基因组计划(IGAP,International Genomics of Alzheimer s Projects)中21,982名阿尔兹海默病患者和41,944名非阿尔兹海默病患者,以及来自衰老相关的欧洲血统研究计划(包括参与者健康时间的长度)中的数据,该计划中包括300,477名健康个体、11,262名长寿个体以及其父母的寿命(来自爱丁堡大学的一项涉及1,012,240名父母的研究)相关数据。随后研究人员分析了这些数据旨在发现与机体衰老和阿尔兹海默病相关的某些基因的重要性,同时他们还利用RNA测序技术(一种能帮助理解哪些基因是活跃的以及其随着机体衰老和疾病发生到底变化了多少的技术)对小鼠和人类进行分析来研究其机体的基因活性,即细胞如何发挥功能以及对环境做出反应。
【8】
doi:10.1016/j.neuron.2024.11.018
大脑中的主要免疫细胞 小胶质细胞(microglia),就像一支精锐的军队,平时守护着我们的神经网络,但在阿尔兹海默病中却可能变成破坏者。近日,一篇发表在国际杂志Neuron上的研究 A neurodegenerative cellular stress response linked to dark microglia and toxic lipid secretion ,揭示了小胶质细胞如何从保护者转变为破坏者的秘密。
研究者表示,小胶质细胞是大脑的第一反应者,在面对疾病时,它们既能提供保护,也能造成伤害。这种双重角色让科学家们感到困惑:为什么同样的细胞既能保护大脑健康,又能加剧神经变性?为了揭开这个谜团,纽约城市大学的研究团队深入探讨了有害小胶质细胞的本质,并找到了一种新的途径来这些细胞。
研究人员发现,当小胶质细胞感受到压力时,它们会激活一条名为整合应激反应(ISR, integrated stress response)的通路。这条通路就像是一个紧急开关,一旦触发,就会促使小胶质细胞产生并释放毒性脂质。这些脂质如同 化学武器 ,能够损伤对大脑功能至关重要的神经元和少突胶质细胞祖细胞(oligodendrocyte progenitor cells)。在阿尔兹海默病患者的大脑中,这类细胞受到的影响尤为严重。
【9】
doi:10.1126/science.adk7844
阿尔兹海默病(AD)和其它与脱髓鞘相关的年龄相关疾病往往会表现出一定的性别差异。近日,一篇发表在国际杂志Science上题为 Tlr7 drives sex differences in age- and Alzheimer s disease related demyelination 的研究报告中,来自美国威尔康乃尔医学院等机构的科学家们通过研究发现,抑制名为TLR7的免疫信号蛋白或能在阿尔兹海默病和普通衰老期间帮助保护机体大脑神经纤维周围的保护层。
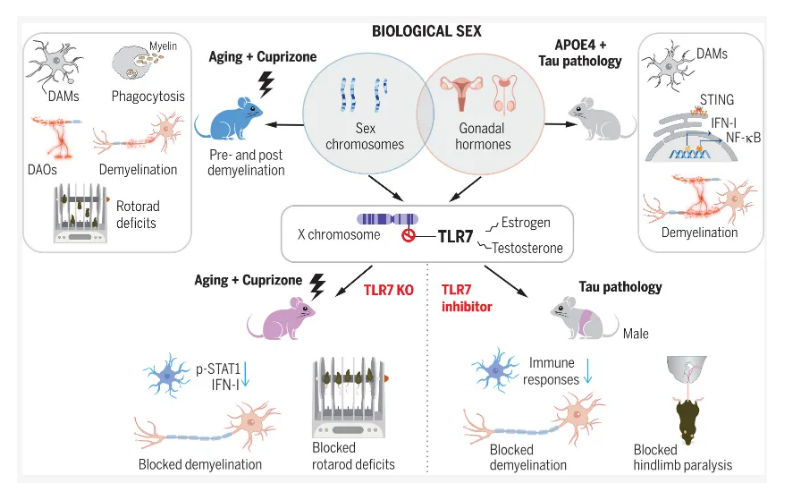
生物性别差异或能通过Tlr7来调节年龄或疾病病理学对脱髓鞘过程的反应
脊椎动物机体中的大多数神经纤维都包裹在主要由髓磷脂(myelin)构成的鞘中,髓磷脂是一种能保护纤维并大大提高信号传导效率的特殊蛋白质,脱髓鞘(demyelination)是一种髓鞘的破坏过程,其可能会发生在大脑炎症的背景下,通常会导致机体认知、运动和其它神经系统问题,这种现象常见于症(MS)、阿尔兹海默病、帕金森疾病和其它神经系统疾病以及普通的衰老过程中。
脱髓鞘相关的疾病通常会表现出一定的性别差异,这项研究中,研究人员寻找了或能解释这些差异的脱髓鞘背后的分子机制,通过对阿尔兹海默病小鼠模型进行实验后,他们发现,TLR7或能作为机体炎症脱髓鞘发生的驱动因素,尤其是在雄性小鼠中,但这也表明,移除或抑制这种免疫蛋白或能保护雄性和雌性小鼠抵御脱髓鞘的发生。研究者Li Gan博士说道,我们的研究结果具有潜在的临床意义,同时还强调了在研究诸如阿尔兹海默病等性别偏见的神经系统疾病时需要考虑性别差异的必要性。
近三分之二的阿尔兹海默病患者都是女性,这种差异或许并不能完全用女性平均寿命长于男性这一事实来进行解释,女性也占到了近乎五分之四的多发性硬化症患者的比例,其中脱髓鞘特征尤为显著;从另一方面来讲,帕金森疾病往往以脱髓鞘为特征,但其主要会影响男性,这种性别差异背后的潜在机制在很大程度上或许都是未知的。这项研究中,研究人员通过对老年小鼠进行研究后发现,相比雄性小鼠而言,雌性小鼠往往更容易受到化学诱导形式的脱髓鞘的影响,即会表现出更为严重脱髓鞘和运动异常,而年轻小鼠则会表现出轻微的影响且不会出现性别差异。
【10】
doi:10.1038/s41593-024-01777-2
阿尔兹海默病是一种至少26种以神经元、神经胶质或两者中tau蛋白阳性积累为特征的疾病,然而目前研究人员并不清楚什么样的修饰会引起可溶性tau蛋白转化为不可溶性的聚集体,此前研究人员通过遗传筛选识别出了酪氨酸激酶2(TYK2,tyrosine kinase 2)或许是tau蛋白水平的候选调节子。
近日,一篇发表在国际杂志Nature Neuroscience上题为 TYK2 regulates tau levels, phosphorylation and aggregation in a tauopathy mouse model 的研究报告中,来自贝勒医学院等机构的科学家们通过研究发现,酶类TYK2活能将正常的tau蛋白转化为在大脑中积累的特殊蛋白,并能促进动物模型阿尔兹海默病的发生,相关研究结果表明,部分抑制TYK2或能作为降低tau蛋白水平及其毒性的一种新型策略。
研究者Ji-Yoen Kim教授表示,很多研究都表明,tau蛋白在大脑中神经元和神经胶质细胞中的积累或许是阿尔兹海默病和至少24种神经系统疾病发生的主要特征。此前研究结果表明,tau蛋白会在疾病中发生化学修饰,主要是通过在蛋白质的酪氨酸基团上添加额外的磷酸基团,而且这些改变在调节tau蛋白积累上扮演着至关重要的角色。此前研究者Zoghbi的实验室识别出了酶类TYK2活能向酪氨酸基团添加磷酸基团,同时其也能作为tau蛋白水平的潜在调节子,敲除TYK2基因或能减少人类细胞中tau蛋白的水平。(100yiyao.com)
100医药网更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 【MADI·美械会】日程抢先看!免费门票限时领!评审中心 / 研发企业 / 临床机构齐聚苏州! (2025-10-16)
- 人类皮肤可以产生卵子?!最新Nature子刊:科学家成功将人体皮肤细胞的染色体“减半”,制造出类卵细胞结构 (2025-10-16)
- 面对输赢,男性赢了还想赢,女性赢了却偏向“见好就收”?最新Neuron|原来都是大脑PV神经元在暗中操控! (2025-10-16)
- 《柳叶刀》子刊:戒烟对认知有重要意义!最长18年随访研究显示,戒烟者的长期认知轨迹较吸烟者更好 (2025-10-16)
- 破局之“法”!通过重构宫颈癌供血系统,法米替尼“一箭双雕”,既直接抗癌又协同增效免疫治疗 (2025-10-16)
- Nature Biotechnology:基因“静音”的艺术?不“剪”基因,我们如何实现精准长效的疾病调控 (2025-10-15)
- Cell重磅:人类胚胎干细胞来源的多巴胺能前体细胞,安全有效治疗帕金森病 (2025-10-15)
- Nature:酶功能研究的下一个“利器”!EZSpecificity模型如何重定义酶功能预测的精度边界? (2025-10-15)
- 猪鼻里藏着“抗病毒卫士”!南京农大发现枯草芽孢杆菌 NS12,广谱阻击呼吸道病毒还不易耐药 (2025-10-14)
- Research:肝纤维化有救了?中药成分发现“双面杀手” 精准清除致病细胞 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















