Sci Rep揭秘甘草酸的神奇疗效:甘草酸通过抑制HMGB1减缓结直肠癌进程 |
 |
来源:100医药网 2024-11-04 14:48
甘草酸(GL)能够通过抑制高迁移率组蛋白1(HMGB1)来调节非同源末端连接(NHEJ)通路,从而增强DNA损伤反应,进而有效抑制结直肠癌细胞的增殖,显示出癌症治疗潜力。 (CRC)是全球癌症相关死亡的主要原因之一,其早期症状缺乏,往往导致晚期,增加了治疗难度。尽管手术切除是局部的首选治疗,但在远处转移的情况下,辅助化疗和放疗仍是主要治疗方式。然而,患者在接受这些治疗后,5年生存率仅约10%,这突显了现有治疗手段的局限性,亟需深入研究以寻找新的治疗靶点。
(CRC)是全球癌症相关死亡的主要原因之一,其早期症状缺乏,往往导致晚期,增加了治疗难度。尽管手术切除是局部的首选治疗,但在远处转移的情况下,辅助化疗和放疗仍是主要治疗方式。然而,患者在接受这些治疗后,5年生存率仅约10%,这突显了现有治疗手段的局限性,亟需深入研究以寻找新的治疗靶点。
DNA损伤反应(DDR)在维持基因组稳定性中至关重要,CRC通常由良性病变发展而来,伴随DNA损伤的累积。高迁移率组蛋白1(HMGB1)在DNA修复和肿瘤发生中发挥重要作用,促进非同源末端连接(NHEJ)修复双链断裂。抑制HMGB1可能增强对放疗和化疗的敏感性。甘草酸(GL)作为HMGB1的抑制剂,具备抗氧化、抗炎和抗癌等多种效果。近日,滨州医科大学马延超研究团队在Sci Rep发表了题为Glycyrrhizin ameliorates colorectal cancer progression by regulating NHEJ pathway through inhibiting HMGB1-induced DNA damage response的研究论文,发现GL能够通过抑制HMGB1来调节NHEJ通路,从而增强DNA损伤反应,进而有效抑制结直肠癌细胞的增殖,显示出癌症治疗潜力。

GL在体外有效抑制CRC细胞增殖
对HT29和HCT116细胞进行不同浓度的GL处理后,使用CCK-8法评估细胞活力,结果表明GL以剂量依赖方式抑制细胞活力,其半数抑制浓度(IC50)分别为267.3 M和258.3 M,最终选择300 M用于后续实验。克隆形成实验结果显示,GL处理后CRC细胞的克隆数显著减少。流式细胞术分析表明,GL处理显著增加了细胞凋亡比例,并增强了半胱天冬酶-3的活性和蛋白水平。同时,细胞周期分析显示GL处理后CRC细胞S期比例显著上升。Western blotting结果表明,GL诱导了cyclin D1的表达,而对CDK2无明显影响。这些发现表明,GL有效抑制了CRC细胞的增殖。
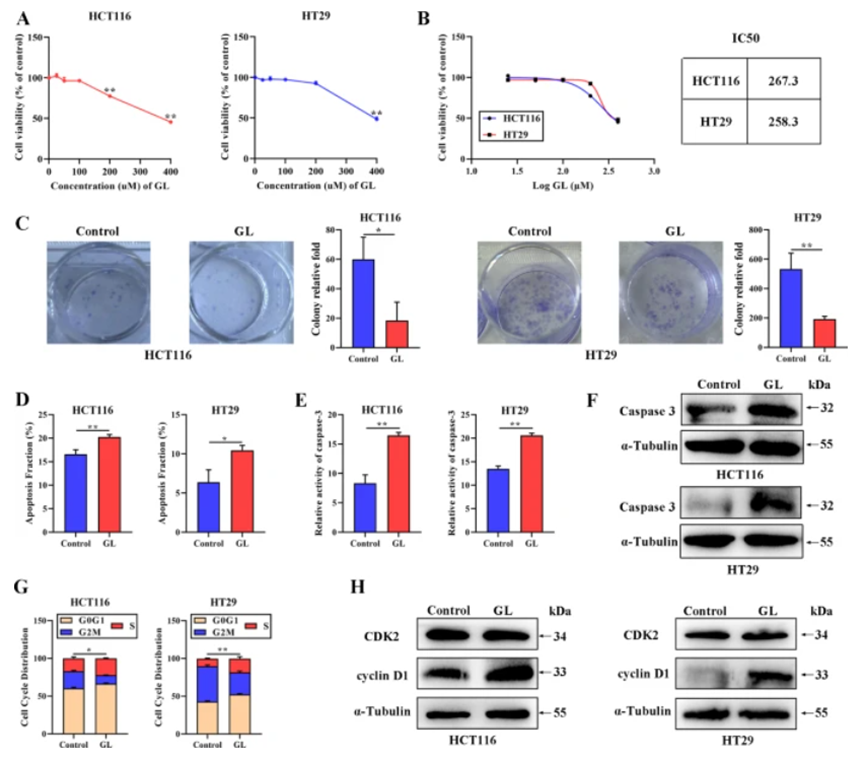
图1:GL对CRC细胞的影响
GL处理通过抑制NHEJ通路加速DDR
研究发现,GL处理后, H2A.x焦点数量在0.25小时至2小时内显著增加,随后逐渐减少,且磷酸化 H2A.x的蛋白水平显著上升。此外,彗星实验结果显示,GL处理显著阻碍了DNA修复能力,同时8-OHdG的产生也显著增加,这与DNA损伤相关的癌变过程密切相关。实时定量PCR分析显示,GL处理后与NHEJ通路相关的基因Ku70、Ku80和XRCC4的表达显著降低,Western blotting进一步证实了Ku70和LIG4的蛋白水平显著减少。这些结果表明,GL处理通过抑制NHEJ通路加速了CRC细胞的DDR。
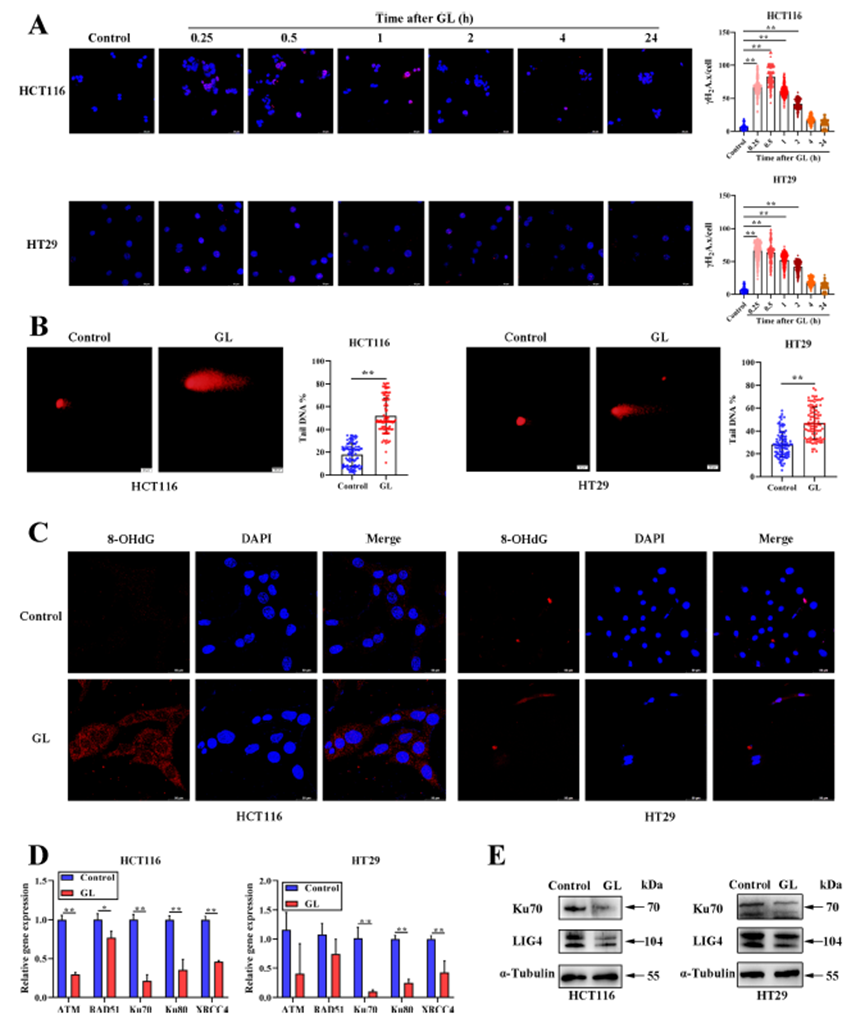
图2:GL对CRC细胞DNA损伤的影响
GL有效抑制了CRC进展
将Balb/c小鼠接种CT26异种移植物后,给予15 mg/kg的GL治疗,结果显示,与对照组相比,GL显著抑制了CT26异种移植物的生长,同时对肿瘤重量没有显著影响。组化染色结果表明,GL处理显著减少了肿瘤组织中Ki67阳性细胞的数量。TUNEL实验显示,GL治疗增加了异种移植物组织中的凋亡细胞数量。此外, H2A.x焦点形成的免疫组化结果也显示,GL处理明显增强了 H2A.x焦点的形成。这些数据表明,GL通过激活DNA损伤反应抑制了CRC细胞增殖。
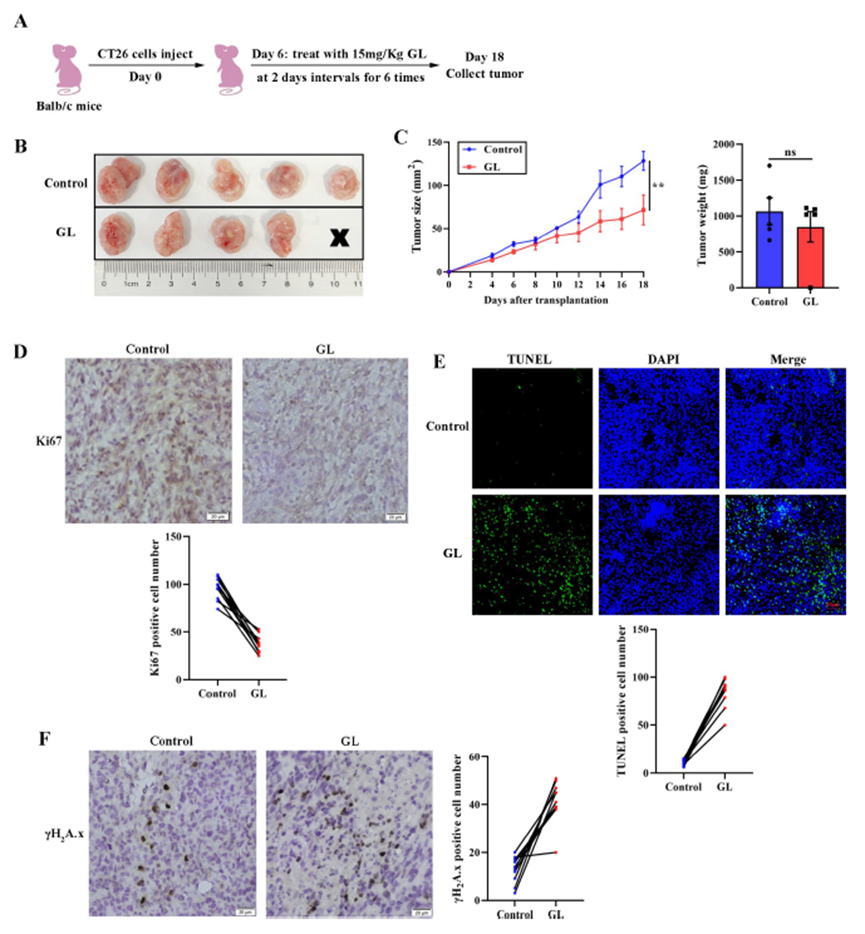
图3:GL抑制了体内CRC细胞增殖
GL通过抑制HMGB1影响CRC细胞增殖
研究显示,GL处理后CRC细胞中的HMGB1蛋白水平显著降低,而HMGB1的过表达则能够逆转GL的抑制效应。在HMGB1过表达的CRC细胞中,GL处理后细胞活力和克隆形成能力明显恢复,同时凋亡细胞比例降低。HMGB1的过表达还减少了GL处理后半胱天冬酶-3的活性及蛋白水平,并降低了S期细胞的比例。此外,HMGB1过表达逆转了GL诱导的cyclin D1蛋白水平上升。这些结果表明,GL通过调节HMGB1的表达来减缓CRC的进展。
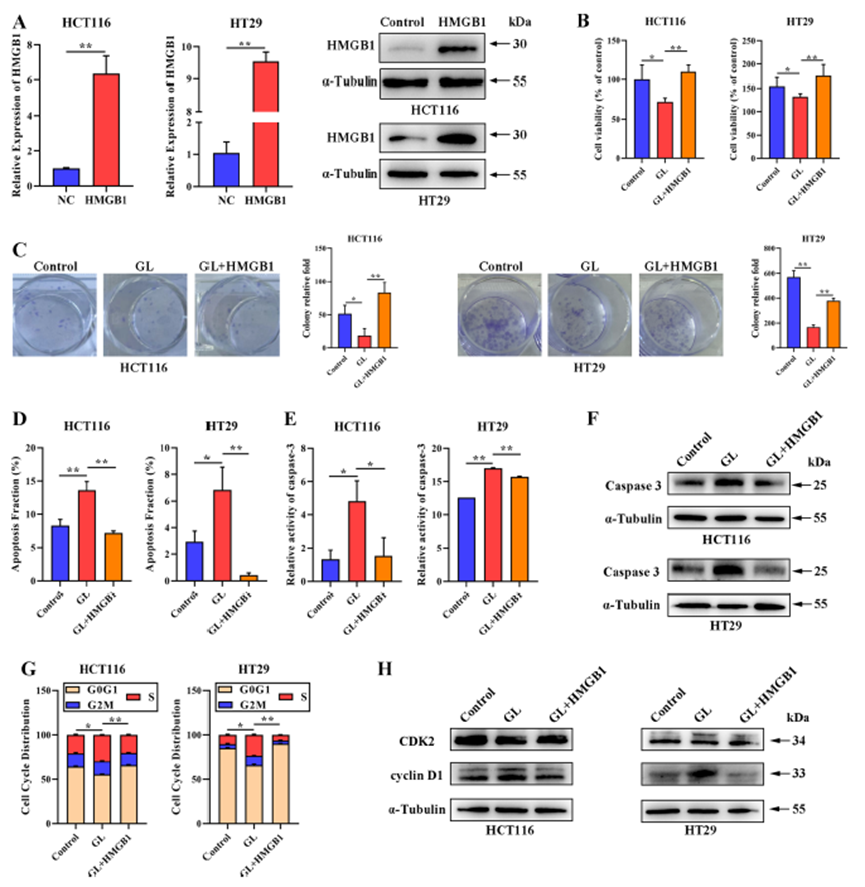
图4:GL通过抑制HMGB1影响减轻CRC细胞增殖
GL通过抑制HMGB1调节NHEJ通路而增强DDR
研究发现,在GL处理后,HMGB1的过表达显著降低了CRC细胞中的 H2A.x焦点形成,并显著提高了磷酸化 H2A.x的蛋白水平。此外,HMGB1的过表达还减少了CRC细胞中DNA尾部百分比,并降低了8-OHdG的产生。同时,HMGB1过表达逆转了GL处理所导致的Ku70和LIG4蛋白水平下降。这些结果表明,GL通过HMGB1依赖性机制调节NHEJ通路,从而促进DNA损伤反应。
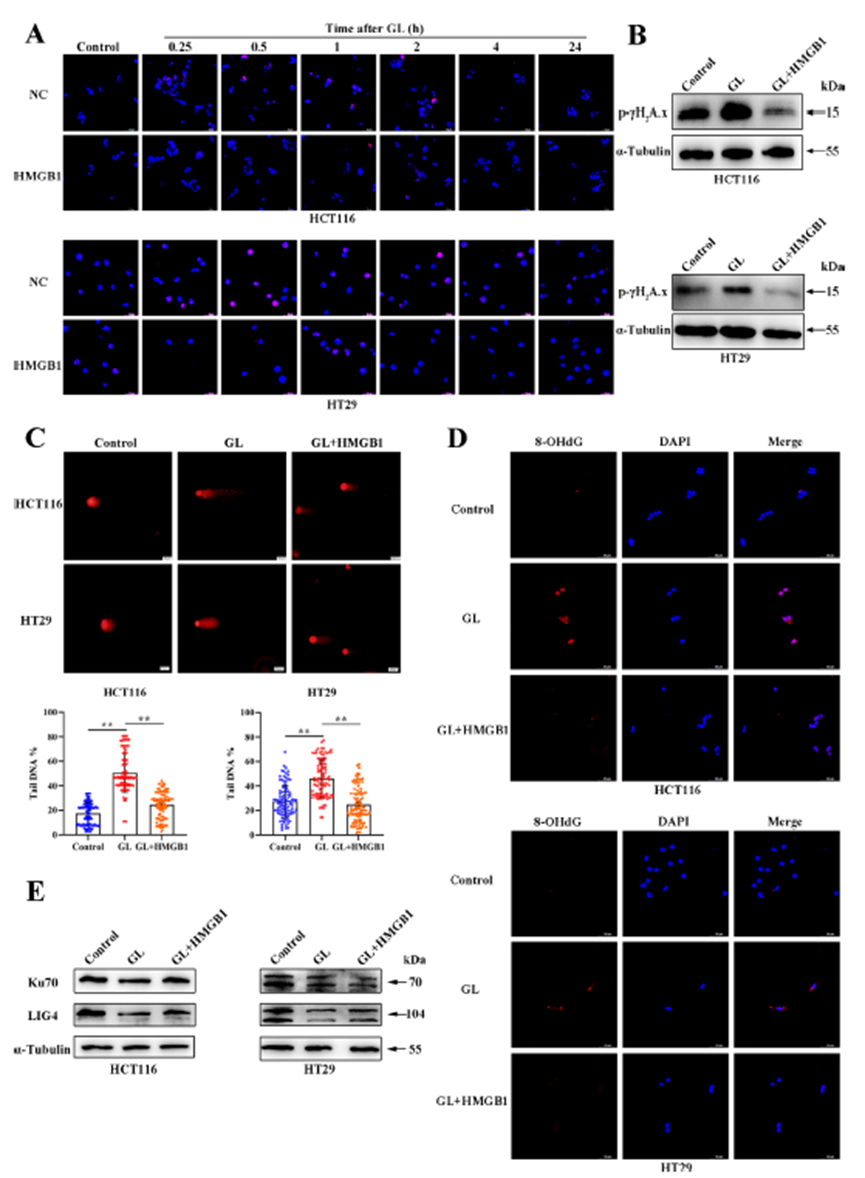
图5:GL通过抑制HMGB1调节NHEJ通路而增强DDR
HMGB1的异常表达与CRC组织样本的总生存率相关
研究分析了80例人类CRC及其匹配的正常邻近组织,结果显示CRC组织中的HMGB1表达显著高于正常组织,并且HMGB1呈现核染色。此外,HMGB1的表达随着肿瘤阶段的增加而上升,临床晚期(III和IV期)的HMGB1水平明显高于早期(I和II期)。Kaplan-Meier分析表明,低HMGB1表达的患者整体生存期显著长于高HMGB1表达的患者。这些结果表明,高HMGB1表达可能是CRC患者不良临床预后的潜在指标。
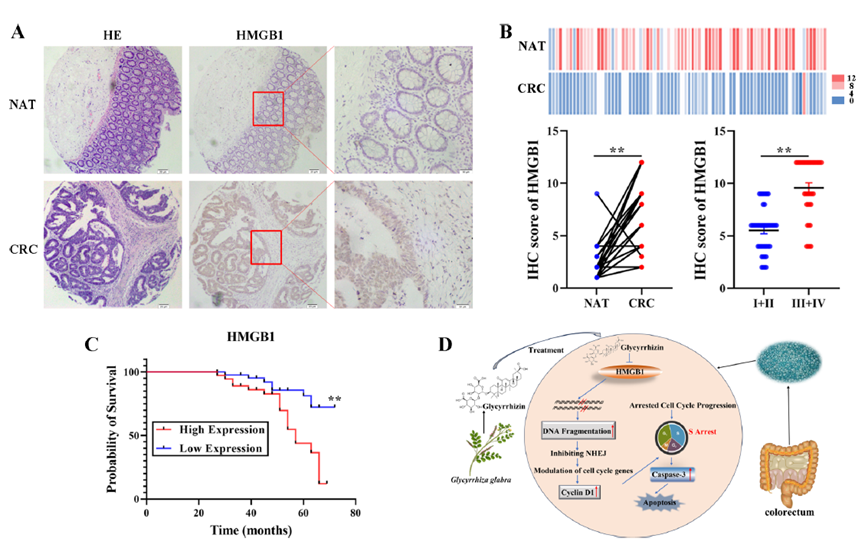
图6:GL通过HMGB1依赖机制减缓CRC进程
总体而言,本研究探讨了甘草酸(GL)在结直肠癌(CRC)中的作用,发现GL通过抑制高迁移率组蛋白1(HMGB1)来增强DNA损伤反应(DDR),从而抑制CRC细胞增殖。实验表明,GL显著诱导细胞凋亡和阻滞S期细胞周期,增加了 H2A.x焦点和8-OHdG的形成,增强了DNA损伤反应。HMGB1的过表达逆转了GL引起的细胞凋亡和DNA损伤反应,且在CRC组织中HMGB1的异常表达与肿瘤分期及预后相关。结果表明,GL通过HMGB1依赖机制减缓CRC进程,显示出癌症治疗潜力。(100yiyao.com)
参考文献:
Han, Y., Sheng, W., Liu, X.et al.Glycyrrhizin ameliorates colorectal cancer progression by regulating NHEJ pathway through inhibiting HMGB1-induced DNA damage response.Sci Rep14, 24948 (2024). https://doi.org/10.1038/s41598-024-76155-w
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- mRNA 稳定性藏“致病密码”!Nat Genet:5000+基因变异竟是免疫疾病推手,新工具破解基因调控盲区 (2025-09-08)
- 老药新用破“休眠炸弹”!Nat Med:羟氯喹+依维莫司清除乳腺癌潜伏细胞,3 年无复发生存率 100% (2025-09-08)
- 护肝片哪个品牌最好最安全?中老年肝脏养护品牌实力排名,肝功能逆转案例追踪揭秘 (2025-09-08)
- 护肝片哪个牌子效果最好?2025跨境护肝片十大安全排名公示,榜首获欧美药监局双认证 (2025-09-08)
- 湖北启动医疗机构免陪照护服务试点 (2025-09-08)
- Nat Struct & Mol Biol:揭秘人类丛生蛋白的3D结构有望阐明阿尔兹海默病的风险因素 (2025-09-08)
- 精准突破囊性纤维化无义突变!Biomed Pharmacother:多模态单细胞技术助力药物筛选新发现 (2025-09-08)
- 吃菠菜竟能 “激活抗癌细胞”!芝加哥大学研究:玉米黄质让 CD8+T 细胞战力翻倍,还能增效免疫疗法 (2025-09-08)
- 重大突破!Nature:CRISPR - Cas9 除基因编辑外,竟还能这样调控细菌免疫 (2025-09-08)
- 十大护肝片品牌推荐,2025护肝片口碑安全品牌榜单揭秘,真实数据助力理性选择 (2025-09-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















