Nature:MSKCC团队研究发现,肠癌细胞竟会自行“返祖”,只为转移! |
 |
来源:奇点糕 2024-11-22 14:22
为了实现远处转移,结直肠癌(CRC)细胞在细胞表型上会“改头换面”,且可塑性非常之强.众所周知,癌症的远处转移灶经常比原发肿瘤更致命、治疗难度也更大,可原因呢?大家可能下意识地会归因于在转移过程中,为逃避系统杀伤和应对各种阻力,修炼出来了各种 邪功 。但近年来的一些研究显示, 邪功 即便存在,也可能没体现在转移灶癌细胞的基因突变当中[1],而更具说服力的解释,则是转移灶癌细胞的细胞表型有所转变。
而近日,美国纪念斯隆-凯特琳癌症中心(MSKCC)发表在《自然》上的研究成果[2]就显示,为了实现远处转移,(CRC)细胞在细胞表型上会 改头换面 ,且可塑性非常之强,说是 时光倒流 都没问题,因为它们竟然能先放弃肠道(ISC)的表型状态,经重编程回退到人类胚胎发育阶段才会有的高度保守性胚胎祖细胞状态!
远处转移灶内CRC细胞的这一手,不仅与原发灶中表型更接近ISC的癌细胞划清了界限,还可以说是以退为进的高招,后续在远处转移过程中和遭遇化疗阻击时,它们还可以发生非经典型分化,蜕变为鳞癌样或神经内分泌样表型,以更强的可塑性适应不同微环境中的挑战,此次研究还揭示了对肠癌细胞这种可塑性有重要调控作用的转录因子PROX1。

论文首页截图
研究者们之所以会怀疑CRC细胞发生了表型转变,是既往研究显示CRC往往起源于LGR5+肠道干细胞,但转移灶中却存在大量LGR5-癌细胞[3],且同时还可能伴随着L1CAM等分子的表达水平改变[4],不过这种转变的过程却还有太多未知之处,其影响更是未知数。
为了拨开笼罩着未知的迷雾,MSKCC研究者们收集并分析了31例CRC患者的正常结肠、原发癌灶和转移灶配对组织样本,并建立相应的类器官模型,再借助单细胞RNA测序和免疫荧光染色,寻找三种组织样本间有显著差异的特征表现。
而第一步对样本中肿瘤上皮细胞的主成分分析(PCA),结果就有点出乎研究者们的预料:具体来说,与正常结肠组织细胞相比,肠道原发灶内的CRC细胞有更高水平的ISC基因特征,如LGR5等WNT信号通路靶基因、胚胎发育基因(BMP7等)和应激反应基因(UPR1、MTORC1)的表达上调,但转移灶内CRC细胞的ISC基因特征却低于原发灶内的同党们。
接下来,研究者们又依据测序中癌细胞表达的37个基因程序确定了10个模组(module),其中6个被定义为 非经典模组 ,即与癌细胞不按套路出牌,向非肠道细胞状态分化有关,如鳞状细胞样模组(KRT5, ELF5)和神经内分泌样模组(WNT5B, BMP4),而转移灶CRC细胞中出现这些模组的频率显著更高,它们也与CRC患者的不良生存预后显著相关。
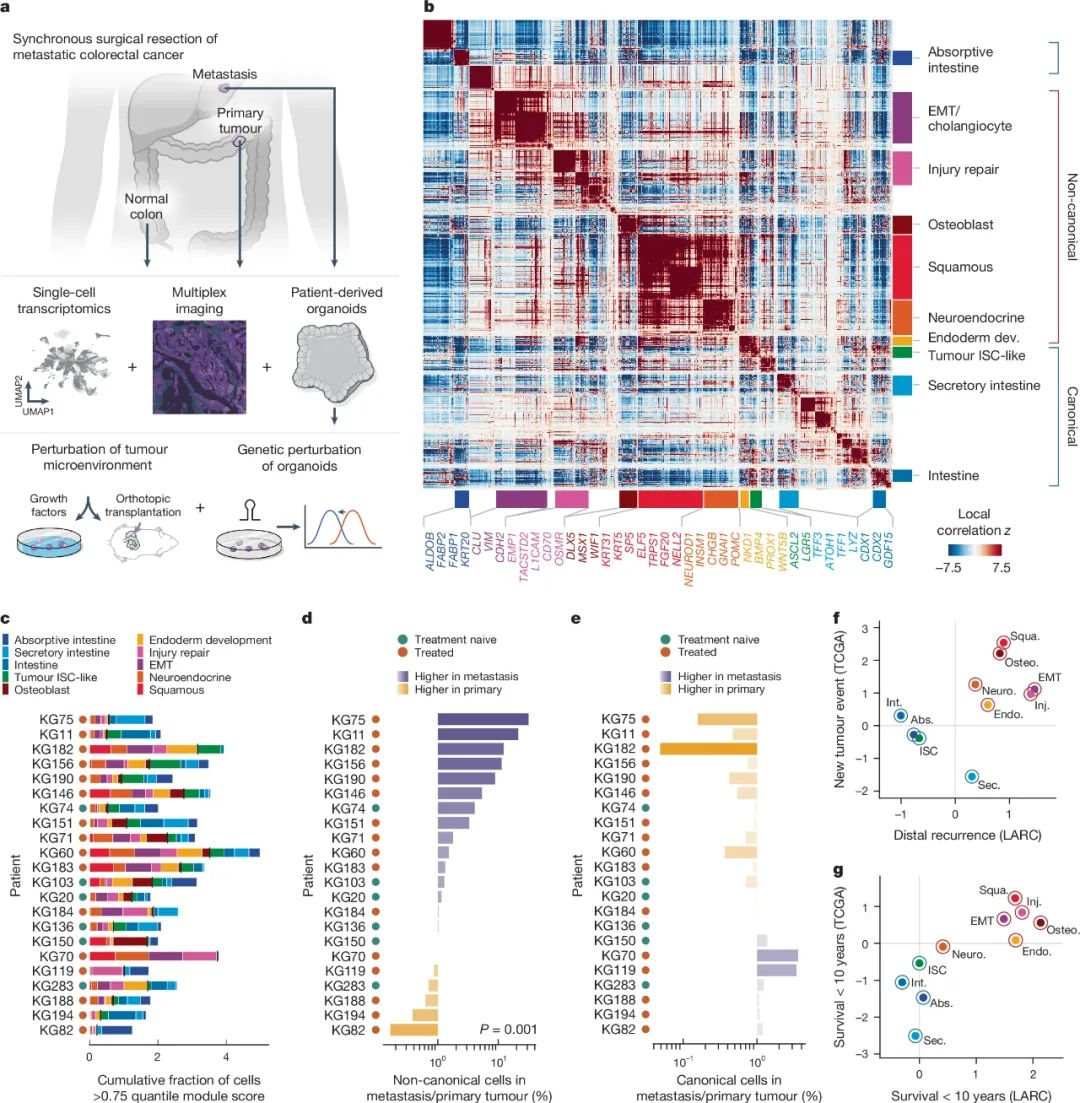
CRC细胞表达的非典型模组,与远处转移及不良预后相关
可以说,转移灶内的CRC细胞确实走上了与原发灶癌细胞截然不同的道路,但这种各走各路发生在什么阶段呢?研究者们注意到了此前模组中有一个 内胚层发育模组 (同样对应WNT5B, BMP4),它似乎处在经典与非经典模组的中间态,于是研究者们比对了胚胎时期的结肠细胞基因特征和CRC患者的基因特征,并将胚胎时期基因特征沿着肿瘤进展的曲线进行标记,证实在CRC发生和远处转移过程中,CRC细胞的表型确实会回到类似胚胎阶段的状态。
整体来看,这些细胞经历的轨迹为:LGR5等标志性基因阳性的ISC会癌变导致CRC原发灶生成,随后导致远处转移的CRC细胞就会以退为进,去分化脱离ISC特征并表达非经典模组基因,从而返回到高度保守的胚胎祖细胞状态,表现出了很强的可塑性,而Wnt信号通路的激活可能对这一过程有重要影响;此外,微环境中的转录因子水平改变或化疗等外界因素,也会对非经典模组和胚胎时期特征基因的表达水平产生影响。
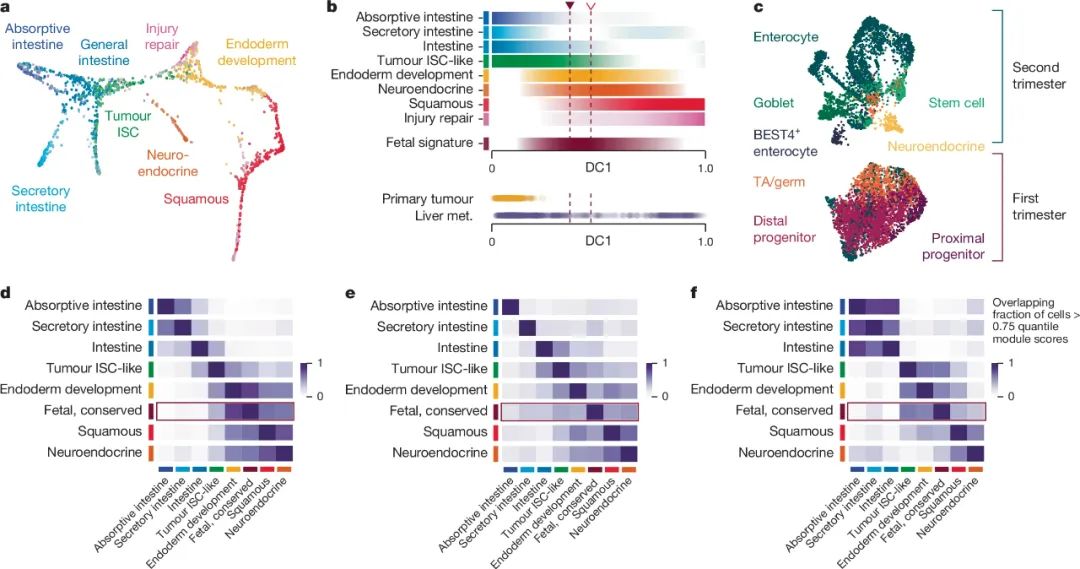
胚胎期基因特征 处在经典与非经典模组的中间地带
最后研究者们还发现,之所以原发灶CRC细胞没有像转移灶同党们一样表现出较强的可塑性,是因为转录调节因子PROX1的存在抑制了非经典模组基因的表达水平,而远处转移或化疗等外因影响会使CRC细胞突破PROX1的压制,即表型状态更少地依赖PROX1调节,有着更强的可塑性,也就成为了更难缠的对手。或许未来的抗癌疗法可以由此入手,紧紧把控癌细胞的表型转变之路,让它们不再变化多端、乖乖束手就擒呢?
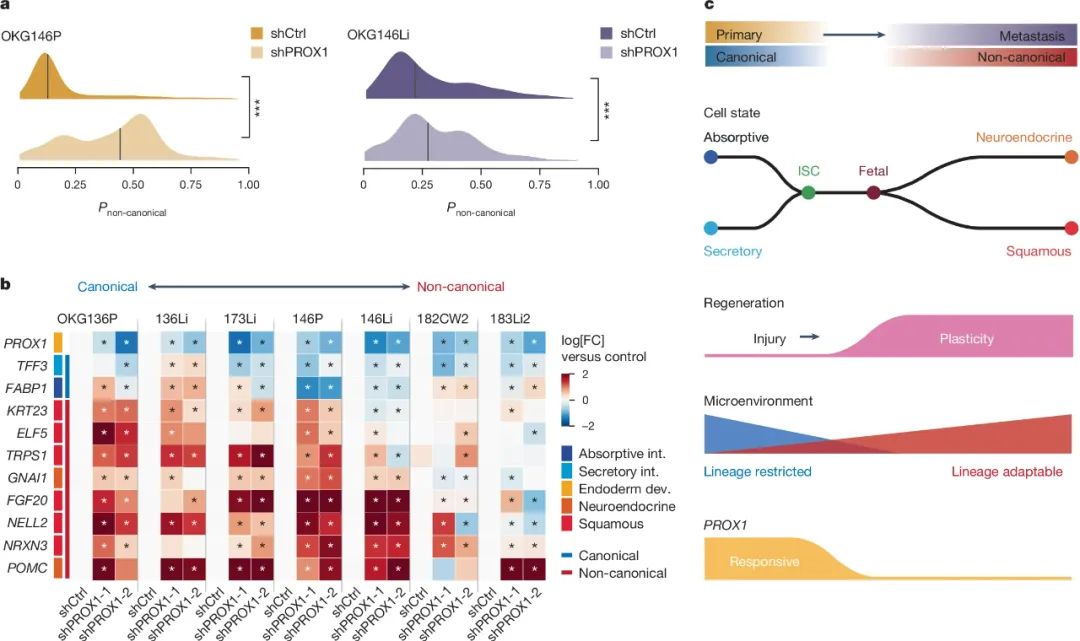
PROX1的存在会限制癌细胞的表型转变可塑性
参考文献:
[1]Mart nez-Jim nez F, Movasati A, Brunner S R, et al. Pan-cancer whole-genome comparison of primary and metastatic solid tumours[J]. Nature, 2023, 618(7964): 333-341.
[2]Moorman A R, Benitez E K, Cambuli F, et al. Progressive plasticity during colorectal cancer metastasis[J]. Nature, 2024.
[3]Fumagalli A, Oost K C, Kester L, et al. Plasticity of Lgr5-negative cancer cells drives metastasis in colorectal cancer[J]. Cell Stem Cell, 2020, 26(4): 569-578. e7.
[4]Ganesh K, Basnet H, Kaygusuz Y, et al. L1CAM defines the regenerative origin of metastasis-initiating cells in colorectal cancer[J]. Nature Cancer, 2020, 1(1): 28-45.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 11家创新药公司完成新一轮融资! (2025-09-25)
- 自闭症社交障碍有破解之法?Nat Commun:大脑里的“社交激素”通路断了,激活受体就能修复 (2025-09-25)
- 不分时间“秒睡”,警惕这种被忽视的病!全球数十款新药加速冲刺,正在为患者点亮希望 (2025-09-25)
- 每月吃 1 片就能防 HIV ?PLoS Biol:一种新型HIV抗逆转录病毒口服药来了,长效还抗耐药 (2025-09-25)
- 益生菌来源 EVs 攻克脂肪肝!Front Immunol:无需活菌定植的“益生菌精华”,降肝酶、稳血脂还护肠道 (2025-09-25)
- 《自然》子刊:鼻腔菌群也能影响大脑!上海交大/上科大团队发现,鼻腔金黄色葡萄球菌通过降解性激素介导抑郁行为 (2025-09-25)
- 老药新用!黄波团队发现碳酸锂可逆转肺纤维化,清除“瘢痕制造者”肌成纤维细胞 (2025-09-25)
- Cell:一种保护性涂层有望让通用型CAR-T细胞疗法成为可能 (2025-09-25)
- 原来植物也有“疗伤因子”!ACS Appl Mater Interfaces:丹参来源囊泡,让受损神经在大鼠身上“重连” (2025-09-25)
- 精鼎医药宣布任命 Rob Goodwin 担任公司首席运营官 (2025-09-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















