Immunity:许琛琦/王皞鹏团队设计可相分离E |
 |
来源:生物世界 2024-12-02 11:18
该研究在传统二代CAR分子胞内段引入TCR中的CD3ε元件(E-CAR),并且对CD3ε进行了序列优化,提高E-CAR在细胞膜上的稳定性。中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究组联合上海科技大学王皞鹏研究组,在 Immunity 期刊发表了题为Phase separation of chimeric antigen receptor promotes immunological synapse maturation and persistent cytotoxicity 的研究论文。
该研究在传统二代CAR分子胞内段引入TCR中的CD3ε元件(E-CAR),并且对CD3ε进行了序列优化,提高E-CAR在细胞膜上的稳定性。E-CAR分子可以通过cation-pi相互作用产生液液相分离(LLPS),帮助突触的形成与成熟;这不仅增强了E-CAR分子本身的信号功能,也能招募CD2等共刺激分子,更好地利用内源共刺激信号。E-细胞比普通的CAR-T细胞具有更高的抗原敏感性,以及更好的持续杀伤能力,在初发肿瘤和复发肿瘤的动物模型中,展示了更好的抗肿瘤功能。目前E-CAR已经进入临床试验阶段,展示了很好的应用前景。

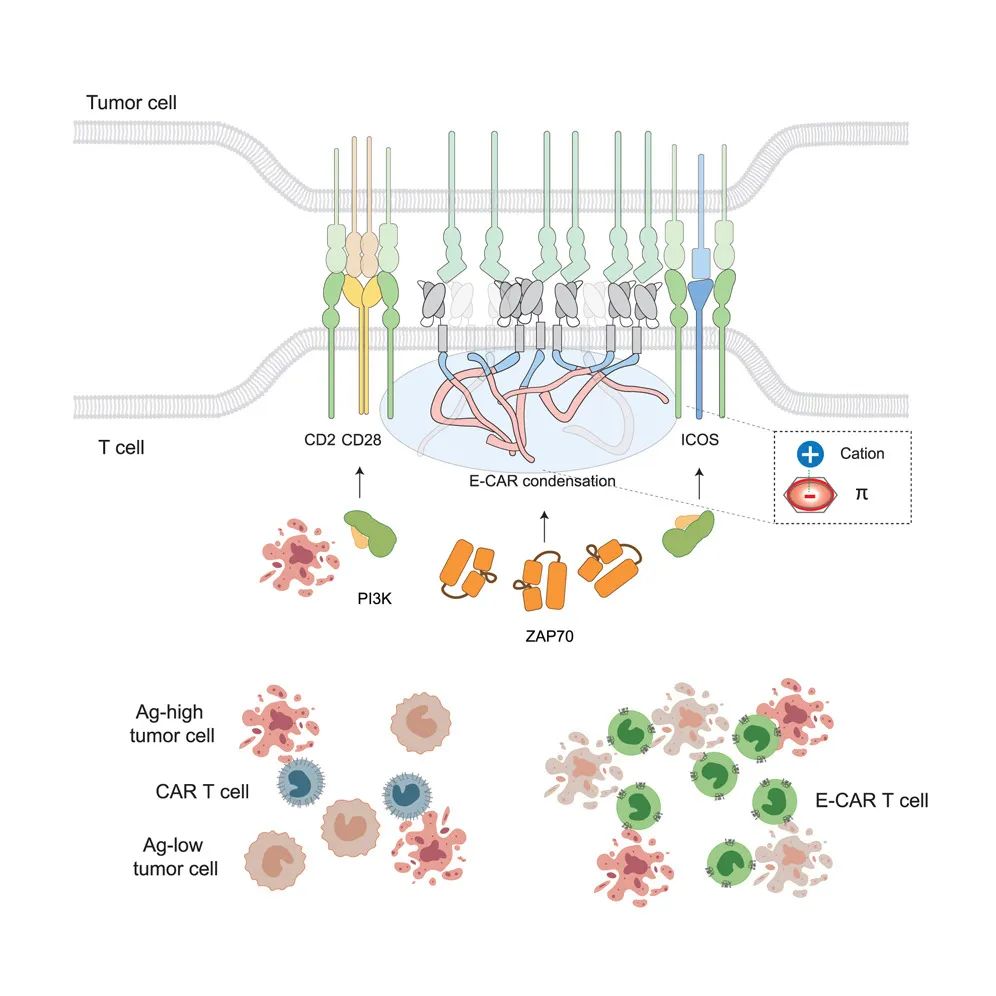
可相分离的E-CAR促进T细胞免疫突触成熟,从而提高抗原敏感性和细胞长效性
大多数T细胞的TCR主要由抗原识别亚基TCR 和信号传递亚基CD3ε 、CD3ε 、CD3 组成。CD3分子富含多处功能序列,可以结合不同信号分子,发挥各种调控功能。其中,CD3ε分子的N端是一段碱性氨基酸富集区(Basic amino acid-rich sequence,BRS),紧接着是一段脯氨酸富集区(Proline-rich sequence,PRS),C 端则由一段包含RK序列的免疫受体酪氨酸激活基序(Immunoreceptor activation tyrosine-based motif,ITAM)组成。
许琛琦团队和合作者的前期研究发现,当T细胞处于静息状态时,BRS与细胞质膜的酸性磷脂发生静电相互作用,将CD3e的胞内区屏蔽在膜内,防止T细胞产生过强的基底信号(Xu et al., Cell 2008);抗原刺激TCR后,钙离子大量内流,中和酸性磷脂的负电荷,从而打破BRS和酸性磷脂的静电相互作用,释放CD3ε胞内区(Shi et al., Nature 2013);CD3ε BRS随后和酪氨酸激酶LCK发生静电相互作用,促进TCR-LCK的液液相分离,增强TCR的磷酸化,并进一步促进LCK的活化(Chen et al., PNAS 2023)。磷酸化的CD3ε ITAM可以招募抑制性激酶CSK,抑制LCK活性,并打破TCR-LCK相分离,使得TCR信号回归基线,防止细胞过度活化(Wu et al., Cell 2020)。
许琛琦团队进而将CD3ε引入二代CAR分子,设计了功能上更加模拟TCR的第一代E-CAR。在该论文中,研究团队发现,E-CAR 1.0的胞内信号区自己就能够形成液液相分离,而传统二代CAR分子的相分离现象较弱。这种相分离主要由CD3ε的碱性氨基酸和其它信号区上的酪氨酸所带的pi电子形成的cation-pi相互作用所介导。在细胞水平,E-CAR 1.0更易于在细胞表面聚集,然而E-CAR在膜上的表达水平比传统CAR低。因此,团队通过蛋白序列优化,构建了一种E-CAR 2.0版本(B6I),保留了其相分离所需的碱性氨基酸,并有效地提高了膜表达水平。
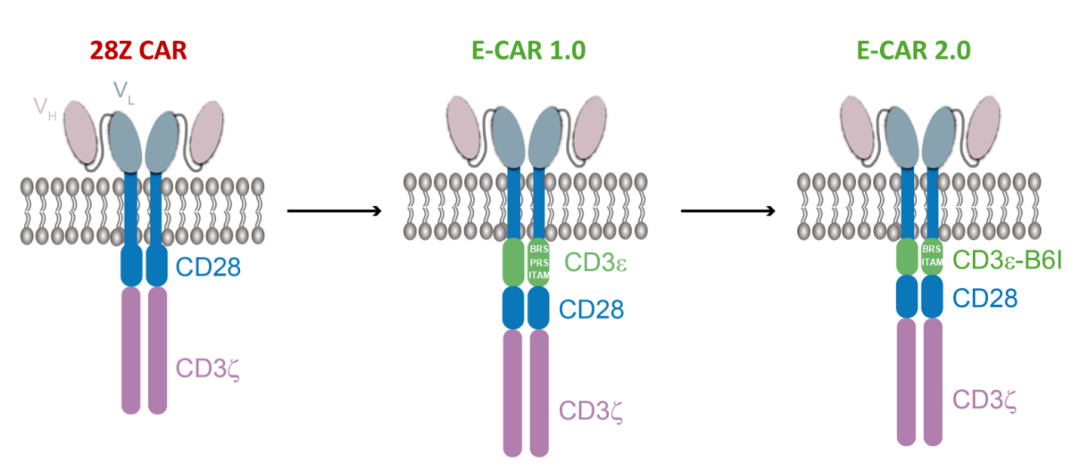
28Z CAR、E-CAR 1.0、E-CAR 2.0模式图
T细胞与靶细胞接触时形成高度有序的超分子激活簇(Supramolecular activation cluster,SMAC),成熟的TCR免疫突触通常是具有 牛眼 样结构,由TCR形成的central SMAC(cSMAC),由黏附分子LFA-1形成的peripheral SMAC(pSMAC)和富含磷酸酶CD45的distal SMAC(dSMAC)。pSMAC和dSMAC之间还有共刺激受体CD2形成的花冠结构,富含CD28、ICOS等多种共刺激分子和PD-1等共抑制受体,共同调控T细胞信号。多层有序的免疫突触结构确保了信号的有效传递。很多研究表明CAR分子不能形成经典的免疫突触结构,CAR分子形成的通常是不规则的微簇结构,这导致其对抗原信号传递低效和对共刺激信号利用不足。与TCR相比,传统CAR分子只利用了CD3 链作为其主要信号传递亚基。其余CD3链的缺失可能导致CAR无法形成成熟的免疫突触。
由于抗原受体聚集是免疫突触形成的基础,E-CAR相分离促进了免疫突触成熟,不仅提升了E-CAR在cSMAC中的信号转导功能,还在外周形成更好的CD2花冠结构,招募PI3K这些信号分子来介导共刺激信号。团队还注意到,E-CAR免疫突触呈现出信号先放大后减弱的动态性,与TCR形成的免疫突触非常相似。
团队接下来研究了E-CAR-T细胞的功能,发现其对弱抗原的结合与杀伤都更强。通过建立肿瘤细胞反复刺激模型,团队发现E-CAR-T细胞的长效杀伤效果更好,在清除肿瘤细胞的同时还可维持自我增殖。RNA测序结果显示E-CAR-T细胞可以利用CD2信号来缓解功能耗竭,这与其能诱导形成CD2花冠结构这一现象吻合。在血液瘤和实体瘤的初发肿瘤动物模型以及血液瘤复发的动物模型中,E-CAR-T细胞都比传统的细胞表现出了更好的抗肿瘤效果。
综上所述,该研究通过蛋白设计,构建了可相分离的新型E-CAR分子,提高了免疫突触质量,从而提高了抗原敏感性和细胞持续性,在动物模型中取得了很好的疾病治疗效果。
E-CAR胞内段相分离就像睡莲的根茎交错缠绕,吸引来的各种小鱼意味着成熟的免疫突触招募了各类下游信号分子,介导T细胞的免疫应答反应
中国科学院分子细胞科学卓越创新中心许琛琦研究员和上海科技大学生命科学与技术学院王皞鹏研究员为论文共同通讯作者。分子细胞科学卓越创新中心博士研究生徐心怡、上海科技大学与分子细胞中心联合培养硕士研究生陈昊天、分子细胞中心博士研究生任正旭、国科大杭州高等研究院硕士研究生徐晓敏为论文共同第一作者。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 炎症TSLP赛道,有“弃子”变“黑马” (2025-09-13)
- Nature:科学家成功利用新算法揭开癌症“黑匣子”并预测肿瘤的演变和临床进程 (2025-09-13)
- Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制 (2025-09-12)
- Nat Commun:口腔微生物界的“超级英雄”!科学家揭示细胞外遗传元素Inocle的发现与意义 (2025-09-12)
- Trends Biotechnol.:武汉大学陈刚/余自力等团队提出FACTORY全自动 EV 分离平台,把 EV 分离从“小作坊”直接升级成“标准化工厂” (2025-09-12)
- EMBO Mol Med:罕见基因突变有望揭示肠道干细胞的再生奥秘 (2025-09-11)
- STTT:打断肿瘤的“狗腿”!科学家发现,抑制中性粒细胞的STAT3,会让中性粒细胞“改邪归正”,促进T细胞抗癌 (2025-09-11)
- Cell:IL-25诱导的记忆2型固有淋巴细胞,强化黏膜免疫 (2025-09-11)
- Nature Medicine:靶向休眠肿瘤细胞,预防乳腺癌复发 (2025-09-11)
- PLoS Biol:肠道真菌与人类健康——科学家揭秘基因与微生物的神秘联系! (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















