研究揭示S |
 |
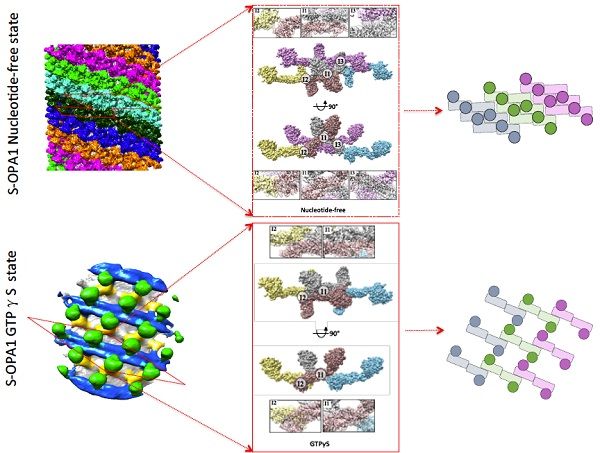
4月14日,中国科学院生物物理研究所生物大分子国家重点实验室孙飞课题组在eLife上发表题为Cryo-EM structures of S-OPA1 reveal its interactions with membrane and changes upon nucleotide binding 的研究成果。该项工作研究了人源线粒体内膜融合蛋白S-OPA1(Dynamin家族短型视神经萎缩蛋白)与线粒体内膜结合组装的模式,发现了核苷酸结合所引起的S-OPA1构象和组装的变化,提出了核苷酸结合所触发的膜形变的分子机理。线粒体作为高度动态的细胞器,在细胞内呈现复杂动态的网络形式。这种复杂网络结构由线粒体的融合和分裂行为进行动态调节,但是线粒体的双层膜结构给研究其融合和分裂行为的分子机制带来了挑战。视神经萎缩蛋白OPA1是介导线粒体内膜融合的关键蛋白。在生理状态下,OPA1通过蛋白酶水解形成锚定在线粒体内膜上的长型L-OPA1和可溶的短型S-OPA1两种活性形式。在L-OPA1与S-OPA1的共同作用下,线粒体内膜融合得以正常进行。当细胞处于一定压力条件下,L-OPA1被全部剪切为S-OPA1,线粒体的融合过程被抑制。近期生物大分子国家重点实验室胡俊杰课题组在PNAS发表了酿酒线粒体内膜融合蛋白——Dynamin家族蛋白S-Mgm1的晶体结构,阐明了S-Mgm1如何通过高聚化促使线粒体内膜融合以及脊的生成。然而S-OPA1促使内膜融合具体分子机制尚不清楚。孙飞课题组利用冷冻电镜螺旋三维重构技术,解析了剪切的短型S-OPA1与脂质体形成的螺旋三维结构。结构表明,与经典的Dynamin家族蛋白结构类似,S-OPA1也可分为用于GTP水解的GTPase结构域,介导高聚组装状态形成的Stalk区域和膜结合相关的EMB结构域三部分。在螺旋结构中,S-OPA1呈现出六股螺旋同时组装的高聚形式,组装中的最小不对称单位为二体,相邻不对称单位之间有4个相互作用面,分别为I1,I2,I3,和P1。这些作用面对stalk区域的相互作用及成管起至关重要的作用。突变体实验表明EMB结构域中存在促使S-OPA1引起膜形变并进行管状组装的关键位点。进一步突变体实验表明S-OPA1的成管过程与GTP的结合和水解无关,然而膜结合对于S-OPA1的GTP水解活性有显着增强作用,提示GTP水解发生在S-OPA1促进膜融合的晚期过程。孙飞课题组又进一步借助冷冻电子断层三维重构和体平均技术解析了GTPγS结合状态下S-OPA1与脂质体形成的管状复合物三维结构。与未结合核苷酸的结构相比,GTPγS结合之后的S-OPA1通过调节自身构象和组装方式,使得其在脂质体管上的排列更加松散,从而引起了脂质体管直径的扩张,这与过去Dynamin家族蛋白引起脂质体管直径的缩小恰好相反,这一现象与OPA1诱导线粒体内膜融合的功能密切相关。( 100yiyao.com)
医药网新闻

- 相关报道
-
- Nat Commun:大脑“幕后操控者”现身!科学家揭秘纹状体星形胶质细胞如何影响机体肥胖与代谢? (2025-07-09)
- Gut:四川大学团队发现肠癌“催肥肝脏”,为后续肝转移作铺垫的关键机制 (2025-07-09)
- 解读:制止将“空肠回肠吻合术”利用于2型糖尿病医治 (2025-07-09)
- 《对于放慢推动普惠托育服务系统建设的意见》答记者问 (2025-07-09)
- 青海实现“医保影像云”部署 完成影像查看成果共享共用 (2025-07-09)
- JAMA子刊:受教育程度高竟成AD负面因素?队列研究发现,在存在显著淀粉样蛋白沉积的情况下,受教育程度高与tau蛋白积累更快有关 (2025-07-09)
- 诺华首款新生儿及婴幼儿疟疾治疗药物获批 (2025-07-08)
- 24岁或就埋下痴呆隐患!性格不好还易“加速”脑萎缩!两项研究:首次在24-44岁健康个体中检出痴呆风险因素;性格对脑健康很重要 (2025-07-08)
- 河北省医保局对于规范综合诊查类医疗服务价钱名目的关照 (2025-07-08)
- 我国树立欠缺食物平安危险隐患外部申报奖励机制 (2025-07-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















