助力移植!一种创新的巨细胞病毒(CMV)药物Livtencity将很快在欧盟获得批准:用于移植受体治疗难治性CMV感染! |
 |
来源:100医疗网原创2022-09-23 17336011
活性是一种新的分子实体,具有比常规治疗更好的疗效和更高的安全性,将重新定义移植受体的CMV感染/疾病治疗。

图片来源:图片网
2022-09-23 /100医疗网BIOON/-武田公司近日宣布,欧洲药品管理局(EMA)的人用医药产品(CHMP)委员会已经发布了积极的审查意见。建议的抗病毒药物livitencity(maribavir):用于接受造血干细胞移植(HSCT)或实体器官移植(SOT)以治疗一种或多种既往疗法(包括[更昔洛韦]、[缬更昔洛韦]、[西多福韦]、[膦甲酸钠])的成年患者
巨细胞病毒感染是SOT和HSCT患者常见的严重临床并发症,可导致严重后果,包括移植失败甚至死亡。来自关键3期至(TAK-620-303,NCT02931539)试验的数据显示,在有或无耐药性(R/R)的移植受者中,在清除CMV病毒血症和维持症状控制方面,马里巴韦优于IAT,并且由于治疗期间的不良事件,治疗相关的毒性较低。
欧盟委员会将考虑CHMP的积极意见,并在未来几个月内做出最终审查决定。如果获得批准,Livtencity将成为欧盟(EU)针对上述适应症的首个CMV特异性UL97蛋白激酶抑制剂。活性通过抑制CMV蛋白激酶pUL97的活性来阻断病毒复制。
2021年11月,Livtencity获得FDA批准,成为美国首个治疗常规抗病毒治疗难治(有或无基因型耐药)的移植后CMV感染的药物。Livtencity适用于:接受SOT或HSCT治疗移植后对更昔洛韦、缬更昔洛韦、磷酸铵和西多福韦(有或无基因型耐药)难治的CMV感染的成人和儿科患者(年龄12岁,体重35kg)。
maribavir的分子结构式(来源:wikimedia.org)
CMV是一种疱疹病毒,通常会感染人类;40%-100%的成年人有既往感染的血清学证据。CMV在体内通常是潜伏的和无症状的,但它可能在免疫抑制期间被重新激活。免疫系统受损的个体可能患有严重疾病,包括接受与各种移植相关的免疫抑制剂治疗的患者,如造血细胞移植(HCT)或实体器官移植(SOT)。在每年估计的200,000例成人移植中,巨细胞病毒是移植受者中最常见的病毒感染之一。据估计,SOT移植受体的发病率为16-56%,HCT移植受体的发病率为30-70%。
在移植受体中,CMV的重新激活可能导致严重的后果,包括失去移植器官,在极端情况下可能是致命的。移植后CMV感染的现有疗法可能会出现严重的副作用,需要调整剂量或不能完全抑制病毒复制。此外,现有的治疗可能需要或延长住院时间,由于给药。
活性药物成分Maribavir是一种口服生物可利用的抗巨细胞病毒(CMV)化合物。它是首个靶向并抑制pUL97蛋白激酶及其天然底物的CMV抗病毒药物。目前,CMV管理与困难的权衡有关,包括毒性和病毒血症清除的管理。不管耐药性如何,存活率有可能重新定义移植后难治性巨细胞病毒的治疗。
Maribavir属于一类名为苯并咪唑核苷的药物,可以靶向并抑制CMV的pUL97蛋白激酶,从而潜在地影响CMV复制的几个关键过程,包括病毒DNA复制、病毒基因表达、衣壳化和成熟衣壳从感染细胞的细胞核中逃逸。
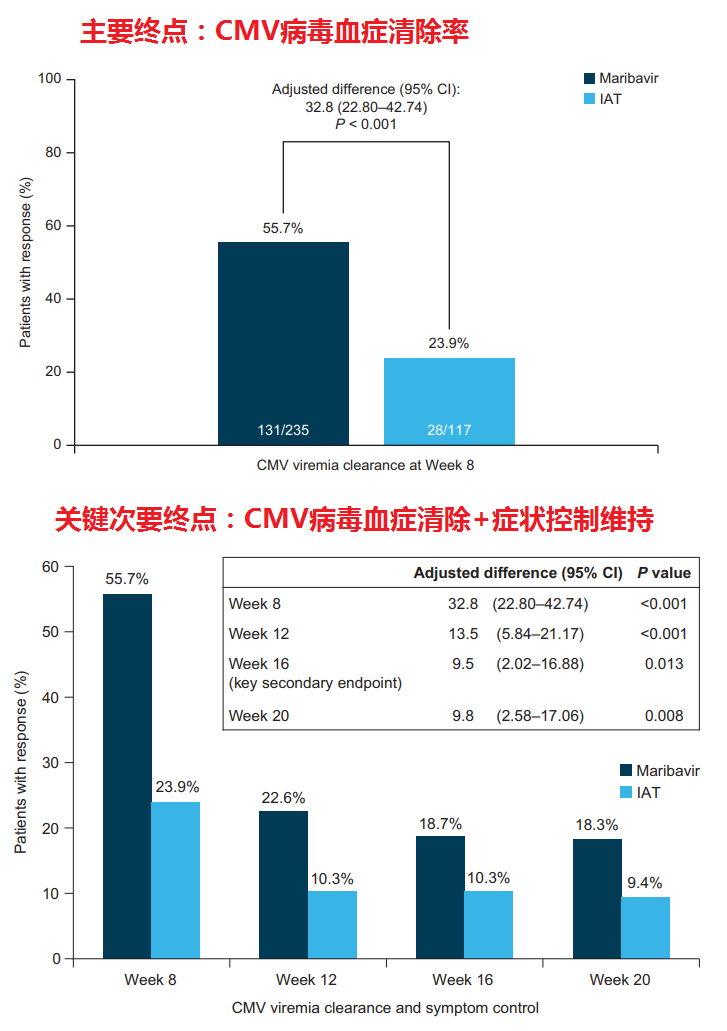
SOLSTICE测试结果(图片来自文献:PMC9464078)
SOLSTICE(TAK-620-303)是一项开放标记的3期研究,在有或无耐药性(R/R)的巨细胞病毒(CMV)感染/疾病的移植受体中进行。马里巴韦联合常规抗病毒药物(研究者指定治疗[IAT]),联合以下一种或多种药物:[更昔洛韦] [本研究的主要终点是治疗第8周末确认的CMV病毒血症清除率,关键
次要终点是第8周实现CMV清除率和症状控制维持至第16周。结果显示,该研究达到了主要终点和关键次要终点:(1)治疗第8周结束时,实现确认的CMV病毒血症清除的患者比例方面,maribavir组是IAT组的2倍以上(55.7% vs 23.9%;调整后的差异[95%CI]:32.8%[22.80-42.74];p 0.001);(2)第8周实现CMV清除率和症状控制维持至第16周的患者比例方面,maribavir治疗组是IAT组的一倍以上(18.7% vs 10.3%;调整后的差异[95%CI]:9.5%[2.02-16.88];p=0.01)。
亚组分析的数据显示:在基线检查时确认为基因型耐药CMV感染的移植受者中,研究第8周时(治疗期结束时)实现确认的CMV病毒血症清除的患者比例,maribavir组是IAT组的3倍以上(62.8% vs 20.3%;调整后的差异[95%CI]:44.1%[31.3,56.9])。
该研究中,2组之间治疗期不良事件(TEAE)发生率相似(maribavir组97.4%;IAT组91.4%)。与膦甲酸相比,maribavir的急性肾损伤发生率更低(8.5% vs 21.3%),与缬更昔洛韦/更昔洛韦相比,中性粒细胞减少症发生率更低(9.4% vs 33.9%)。与IAT组(31.9%)相比,maribavir组因TEAE停止治疗的患者更少(13.2%)。每组有一名患者出现致命的治疗相关TEAE。(100医药网100yiyao.com)
原文出处:Takeda Receives Positive CHMP Opinion for Maribavir for the Treatment of Adults with Post-transplant Cytomegalovirus (CMV) Refractory (With or Without Resistance) to Prior Therapies
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 湖南推进西医药全家当链倒退 2030年总产值突破2000亿元 (2025-10-15)
- 河北做好2025年城乡住民根本医疗保证无关任务 (2025-10-15)
- 解读:福建展开康复病种按床日付费任务的关照 (2025-10-15)
- CLDN18.2 ADC再添强将!SKB315惊艳亮相ESMO (2025-10-15)
- Front Nutr新发现:每天2勺特级初榨橄榄油,帮你“管住”腰围,远离腹部肥胖烦恼 (2025-10-15)
- Nature:生命的“数字孪生”!Giotto Suite如何绘制跨越尺度与模态的终极组织地图? (2025-10-15)
- 槲皮素最好的三个品牌,槲皮素哪个牌子好,槲皮素哪个牌子护肺效果好 (2025-10-15)
- 迈威生物公布靶向 B7-H3 ADC 创新药 7MW3711 将于 2025 ESMO 大会展示的临床数据及最新进展 (2025-10-14)
- 福建三博脑科伽玛刀中心:足不出闽享 (2025-10-14)
- 企业文化与团队建设,晋百慧生物的成长内核 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















