Nature子课题:Rolling/邓增勤合作分析新型细菌CRISPR抗病毒系统的工作机制 |
 |
来源:生物世界2022-10-31 10:03
III-E型CRISPR-Cas系统使用一种称为Cas7-11(也称为gRAMP)的单一多结构域效应子切割RNA,并与半胱天冬酶样蛋白酶Csx29结合,显示了RNA靶向应用的良好潜力。
III-E型CRISPR-Cas系统使用一种称为Cas7-11(也称为gRAMP)的单一多结构域效应子切割RNA,并与半胱天冬酶样蛋白酶Csx29结合,显示了RNA靶向应用的良好潜力。III-E CRISPR-Cas系统的结构和分子机制尚不清楚。
2022年10月27日,天津医科大学Rolling团队和中国科学院中国科学院武汉病毒研究所邓增勤团队发表了一篇研究论文,题目是:一个细菌III-e型CRISPR CAS 7-11复合体的结构和功能。
在本研究中,通过分析Cas7-11复合物在不同状态下的冷冻电镜结构,通过大量的生化实验阐明了Cas7-11加工前体CRISPR RNA(pre-crRNA)、识别和切割靶RNA的机制。我们还发现,Cas7-11对靶RNA的识别可以引起Csx29的构象变化,并可能激活其蛋白酶活性。

CRISPR-Cas系统是细菌和古细菌对抗可动遗传元件入侵的适应性免疫系统。可以分为两类。第一类:由多种效应蛋白功能组成的蛋白复合物,包括型、型和型;通过单一效应蛋白发挥功能的2类包括II型、V型和VI型。最近,研究人员发现了一种新类型的CRISPR-Cas系统,即III-E亚型.该系统在哺乳动物细胞的RNA靶向中具有高活性和低毒性。
与之前发现的多亚基III型系统不同,它由四个Cas7和一个Cas11结构域融合形成一个大效应蛋白Cas7-11/gRAMP,在crRNA的指导下切割靶RNA。Cas7-11可以与半胱天冬酶样蛋白酶(Csx29/TPR-CHAT)(参考文献3)相互作用,形成由CRISPR指导的半胱天冬酶复合物(Craspase)。因此,该系统可能同时具有核酸酶和蛋白酶活性,提示了一种抗噬菌体感染的新机制。
在这项最新研究中,作者首次分析了中国假丝酵母Cas7-11-crRNA(SbCas7-11-crRNA)的二元复合结构。indua Bro DAE,并发现Cas7-11由四个结构相似的Cas7、一个Cas11和一个IPD结构域组成(图1)。IPD是一个位于Cas7.4中部的插入序列,但对其结构和功能的研究尚不清楚。但IPD的删除并不影响靶RNA的识别和切割,提示删除IPD可以构建小型化的基因编辑工具。
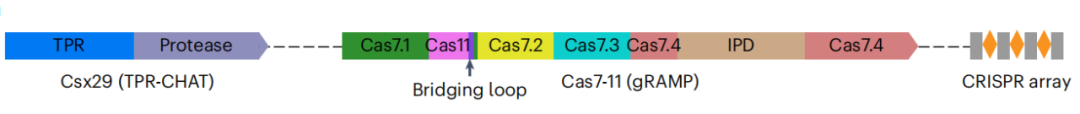
图1 CRISPR-Cas系统iii-e型的基因结构
在传统的III型CRISPR-Cas系统中,Cas6蛋白负责前crRNA的加工和成熟,而Cas7-11蛋白本身具有相应的前crRNA加工能力。Cas7-11 crRNA的结构表明,成熟crRNA的重复序列与Cas7.1结构域结合,因此推测Cas7.1结构域可能具有加工前crRNA的能力。接下来,作者设计了一系列突变实验来寻找Cas7.1的活性位点。由于单体SbCas7-11不稳定,因此选择了来自Desulfonema ishimotonii物种的同源蛋白DiCas7-11进行实验。结果表明,DiCas7-11的4个突变体(W20A、R26A、H43A和Y55A)能明显阻断前crRNA的加工(图2),证明Cas7.1结构域在切割前crRNA中起重要作用。W20和R26在Cas7-11同源物中严格保守,但在SbCas7-11中H43被苏氨酸残基(T45)取代,Y55被苯丙氨酸残基(F57)取代。
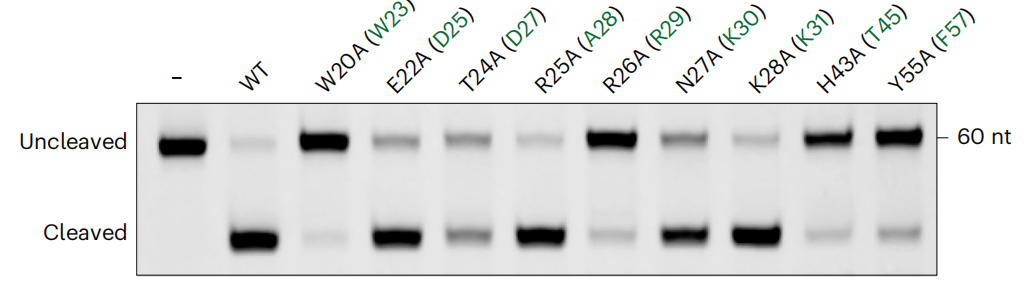
图2体外野生型(WT)和突变型DiCas7-11蛋白的前crRNA切割实验。括号是SbCas7-11的相应残基(绿色)
Cas7-11有两个由6个核苷酸分开的靶RNA切割位点,称为位点1和位点2。cas 7-11-crRNA-靶RNA三元复合物结构发现crRNA序列中的两个核苷酸,4A和10U,分别被Cas7.2和Cas7.3结构域的-指状结构颠倒,表明靶RNA切割可能发生在这两个位点附近。在三
-A/B系统中,Csm3/Cmr4亚基通过催化loop中的一个保守天冬氨酸残基发挥RNase活性。作者通过对比SbCas7-11和Csm复合物的结构,发现在Cas7.3中存在一个对应的保守的天冬氨酸残基(D698)。与预期的一样,D698A突变几乎消除了2位点的target RNA切割(图3左)。然而,在Cas7.2中的对应位置包含一个非保守的丝氨酸残基(S457),并且S457A突变对1位点的切割影响不大。有趣的是,在同一催化口袋中的酸性残基D547的突变,几乎消除了SbCas7-11在1位点的切割活性(图3中)。更有趣的是,序列比对显示,在大多数Cas7-11同源物中,这两个相应位置上一般只会出现一个酸性氨基酸。例如,SbCas7-11有S457-D547,而DiCas7-11在对应的位置上是D429-N518。因此,作者提出了在这两个位置上的氨基酸可能存在功能冗余的假设,并做了功能丧失和功能获得突变来验证这一假设。与预期的一样,结果表明Cas7.2催化口袋的这两个活性位点酸性残基可能在功能上是等价的:两个位置的任何一个天冬氨酸残基都可以对target RNA进行切割(图3右)。
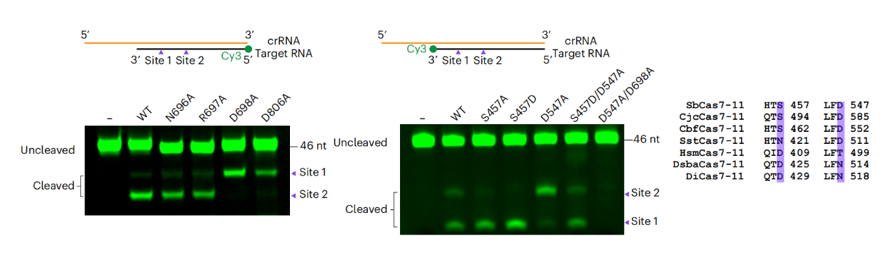
图3 左,Cas7.3结构域突变的体外target RNA切割。中, Cas7.2结构域突变的体外target RNA切割。右, Cas7-11同源物的序列比对
为了研究Cas7-11如何调控Csx29的机制,作者解析了Cas7-11-crRNA-Csx29三元复合物和Cas7-11-crRNA-target RNA-Csx29四元复合物的电镜结构。结构揭示Csx29在target RNA的存在下发生了明显的构象变化:TPR区域靠近Cas7-11,而蛋白酶PS结构域远离Cas7-11,使得Csx29的两个催化残基H585和C627在空间上更加靠近,暴露出其催化口袋(图4)。因此,target RNA的结合很可能可以激发Csx29蛋白酶活性,从而与Cas7-11协同抵抗外源核酸的入侵。该团队关于Csx29蛋白酶活性的测定及切割底物的鉴定等后续工作也证实了这一推断(该部分研究工作正在under revision)。
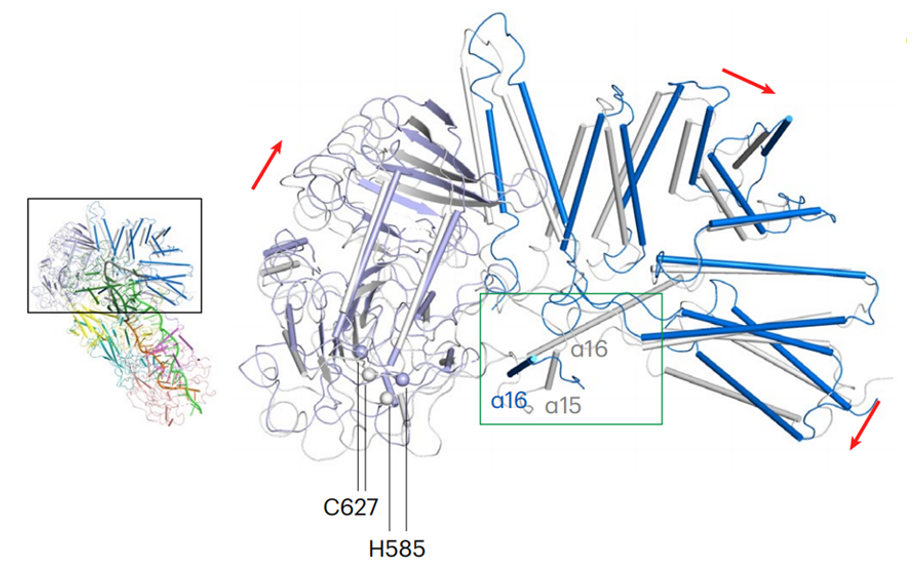
图4 Csx29未结合targetRNA和结合targetRNA时的构象变化
该研究阐述了Cas7-11加工成熟pre-crRNA和切割target RNA的机制,以及Cas7-11对Csx29活性的调控机制(图5)。该研究极大地促进了人们对于CRISPR系统的理解,并为Cas7-11作为安全高效靶向RNA编辑工具的工程化改造提供了结构基础。同时该系统所具有的RNA指导的蛋白酶活性可能为生命科学研究带来新的视角和新的工具。
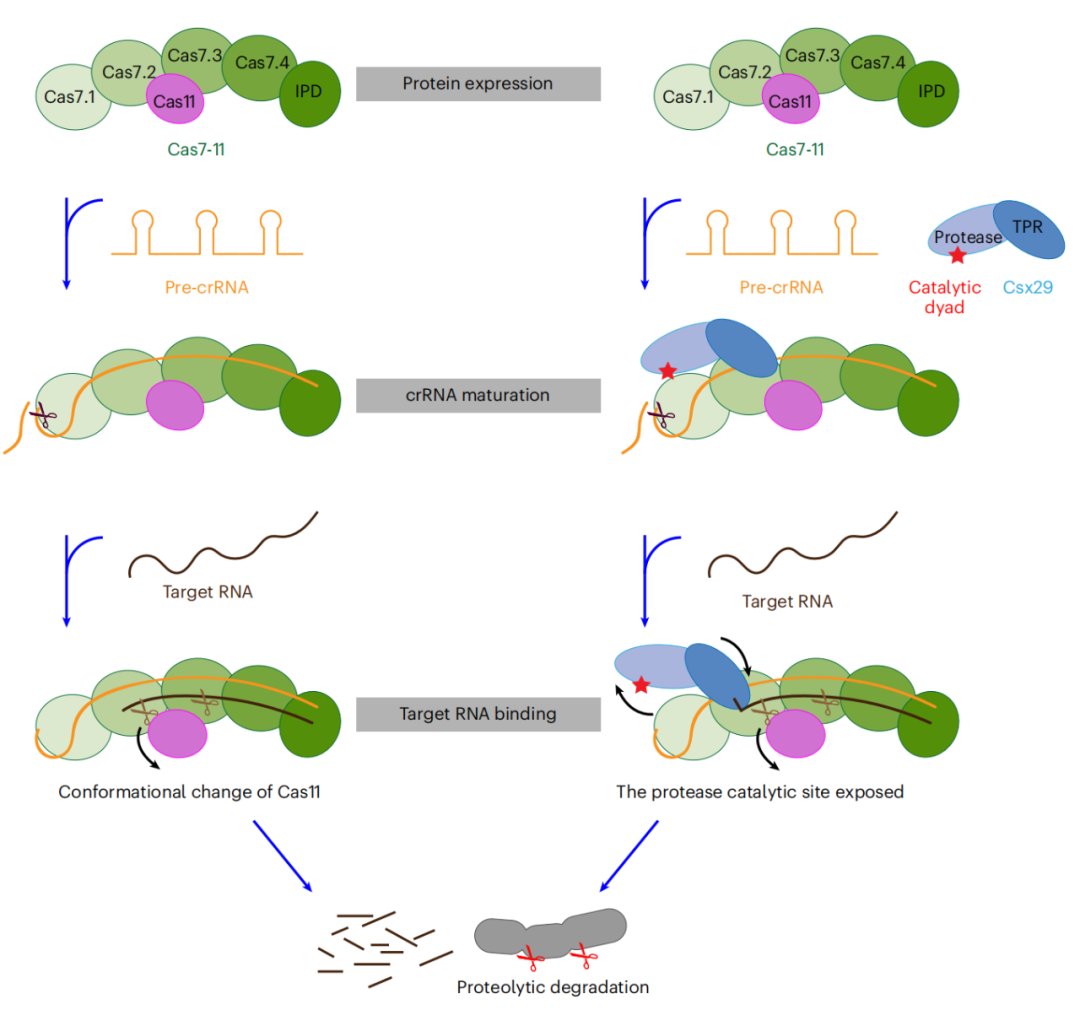
图5文章模式图
天津医科大学张恒教授和武汉病毒所邓增钦研究员为论文的共同通讯作者。天津医科大学基础医学院于桂梅博士、研究生王枭燊、张祎和武汉病毒所博士生安启银为共同第一作者。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- PNAS:免疫疗法新突破!NOD2基因变异助力癌症治疗 (2025-08-06)
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
|
| ||
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |


















