《自然》子刊:/赵伟团队报道支架蛋白相分离调控微生物细胞极性 |
 |
来源:生物世界2022-11-28 10:14
细胞不对称(又称细胞极性)广泛存在于动物、植物和微生物细胞中,其基本特征是母细胞在分裂前经过细胞极化,导致不对称分裂产生两个命运不同的子代细胞。细胞极性是生命世界多样性的根本原因。
细胞不对称(又称细胞极性)广泛存在于动物、植物和微生物细胞中,其基本特征是母细胞在分裂前经过细胞极化,导致不对称分裂产生两个命运不同的子代细胞。细胞极性是生命世界多样性的根本原因,在细胞生长、增殖、分化、发育和细胞功能中起着重要作用。细胞极性紊乱是一些肿瘤(如皮肤癌)的重要表现。在微生物中,细胞极性会产生细胞异质性,导致病原菌耐药耐受(如结核分枝杆菌)、环境抗性或宿主逃逸。
然而,由于由细胞命运决定的调控网络的高度复杂性,我们对细胞极性的理解仍处于初级阶段。如何实现细胞命运决定蛋白在时间和空间顺序上的不对称亚细胞定位,是该领域有待进一步分析的核心问题。新月拟杆菌作为不对称细胞分裂的精细模型,在研究细胞极性方面具有独特的优势。
最近,中国科学院深圳先进技术研究院的赵国平和赵伟发表了一篇题为“相分离模块”(Phase separation modules)的研究论文《自然通讯》中极性相关支架信号枢纽的组装和动力学。
这项研究发现,支架蛋白通过相分离形成具有细胞命运决定功能的无极性膜隔室,揭示了微生物细胞极性构建和动态调控的新机制。

支架蛋白广泛存在于细胞中,通常可以自组装成大分子复合物并将客户蛋白募集到特定的细胞区域,并在包括信号转导、细胞分裂、形态发生和不对称分裂在内的生物过程中发挥作用。在果蝇和秀丽隐杆线虫中发现,Par蛋白可以通过相分离形成无膜隔室,使下游信号蛋白(如PKC或PKC3)不对称定位分布,从而保证胚胎的正常发育。这导致研究小组认为微生物支架蛋白可能通过相分离来调节细胞极性。
研究团队以细胞发育模式微生物新月拟杆菌为研究对象。在每个细胞周期中,新月棒状杆菌可以不对称分裂,产生有鞭毛的聚团细胞和柄细胞(图1)。在细胞分裂之前,一对决定细胞命运的蛋白(磷酸化酶PleC和蛋白激酶DivJ)的极性定位协调了几个下游信号蛋白的磷酸化水平,决定了杆菌新月体的细胞命运。研究表明,蛋白激酶DivJ通过一对支架蛋白复合物PopZ和SpmX被募集到旧细胞极。研究小组之前的工作发现,磷酸化酶PleC被一种潜在的支架蛋白PodJ定位于新的细胞极。然而,微生物支架蛋白如何招募细胞命运决定因素,然后调节细胞极性的机制仍不清楚。因此,研究团队以PodJ蛋白为研究重点,探索新月拟杆菌中细胞极性建立和调控的机制。
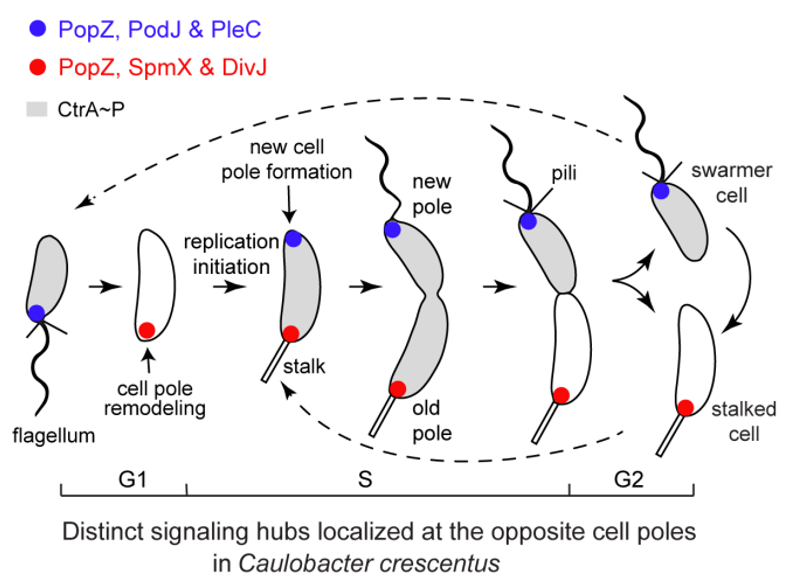
图一。红叶石楠的细胞周期
1.证明极性蛋白PodJ是支架蛋白,具有相分离能力。
首先,研究团队通过活细胞延时摄影证实了PodJ的细胞极定位模式:PodJ特异性识别并聚集在新月拟杆菌的新细胞极。同时,PodJ可在远处的大肠杆菌中表达,并可定位其细胞极性。通过分析蛋白质的聚集特性,研究团队发现该蛋白质可以在体外自发形成大分子聚合物。而且Podj在杆菌新月体和大肠杆菌中的极性聚集不依赖于其他支架蛋白,说明PodJ是一种可以自组装的支架蛋白。
通过分析PodJ的蛋白质序列,研究小组预测PodJ具有典型的内在无序区(IDR)和串联重复序列,暗示了这种蛋白质相分离的潜在可能性。此外,还发现内源性生理蛋白水平的PodJ可以在体外自发形成微米级球形液滴。同时,PodJ还可以在细胞内形成具有典型液滴性质的蛋白质聚集体(图2),表明在体内和体外都可以发生相分离。
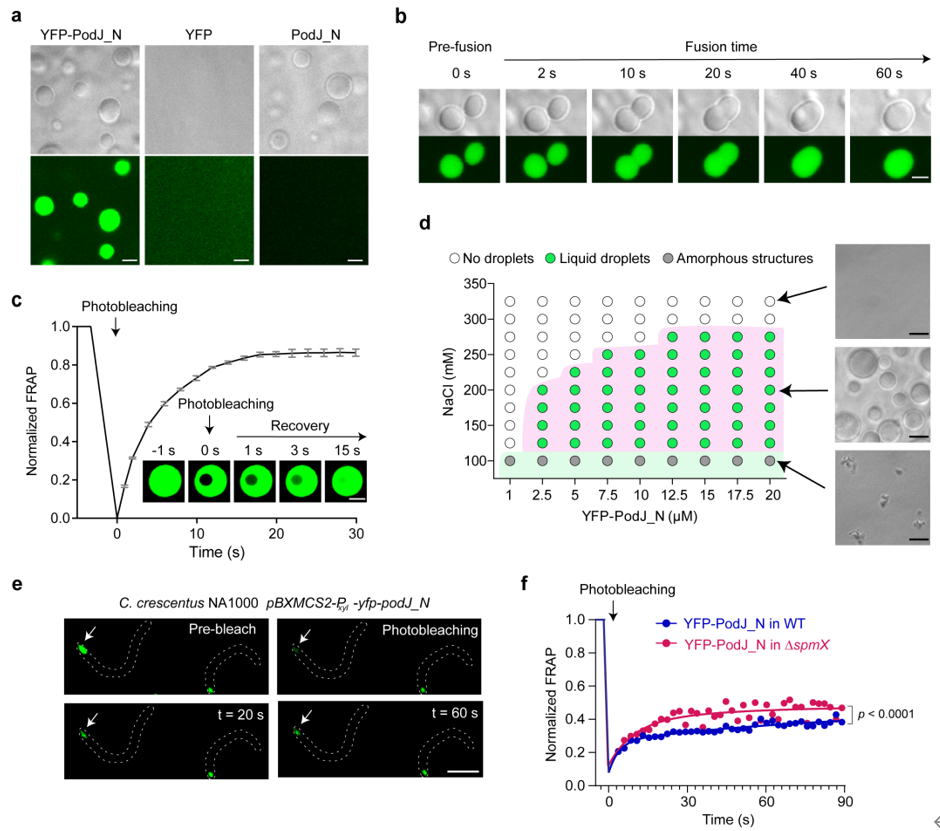
图二。支架蛋白的相分离。A. PodJ在体外经历相分离以形成蛋白质液滴;b . podj蛋白液滴融合特性分析;c . podj蛋白液滴的流动性分析;d .盐离子浓度和蛋白质浓度对PodJ相分离的影响;在e-f. PodJ细胞中发生相分离和流动性分析。
第二,支架蛋白PodJ相分离具有重要的生理功能。
通过大肠杆菌的异源共表达平台,研究团队从新月体C. crescent的23个细胞周期或极性相关蛋白中筛选出PodJ招募的两个新的细胞信号蛋白,即纤毛C。
paE和鞭毛蛋白FliG。在新月柄杆菌中的验证性实验表明,PodJ对PleC、CpaE和FliG等细胞信号功能蛋白的特异性招募都发生在细胞新极(图3)。这些结果说明,脚手架蛋白PodJ可能通过相分离实现细胞区室化,并招募细胞新极相关的信号功能蛋白。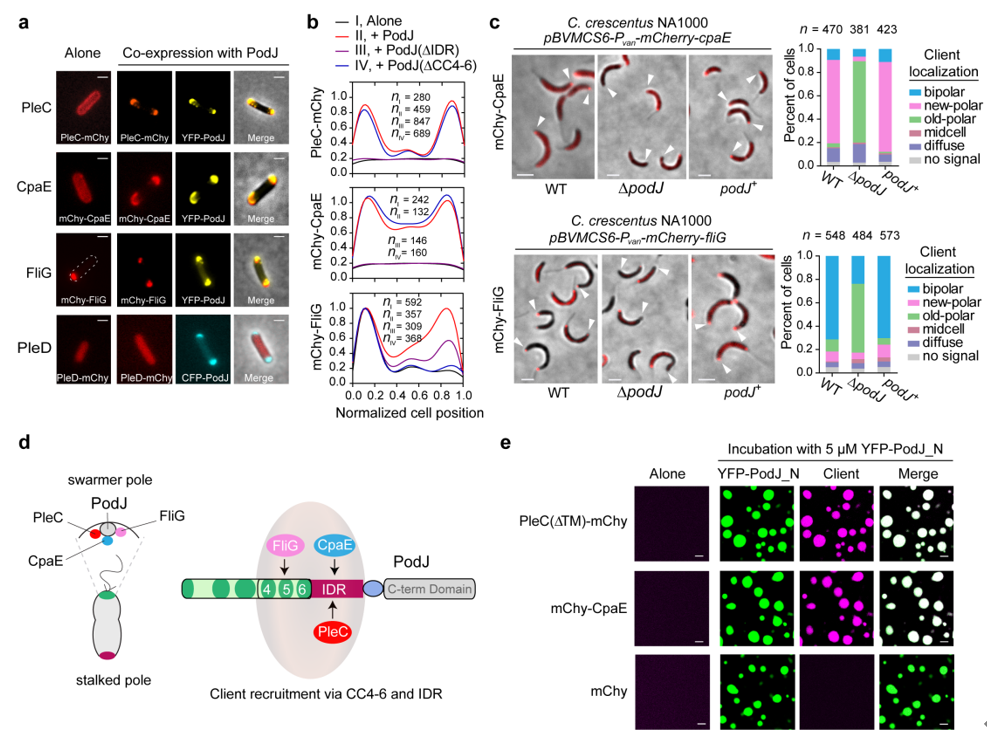
图 3. PodJ细胞区室化的生理功能。a-b.在大肠杆菌中筛选与PodJ相关的细胞信号蛋白;c.在新月柄杆菌中验证PodJ招募相关的细胞信号蛋白;d. PodJ招募细胞信号蛋白模式图;e. PodJ通过相分离招募细胞信号蛋白。
进一步,研究团队对PodJ蛋白的结构和功能域进行了深入挖掘和表征。研究发现,PodJ蛋白的IDR和CC4-6两个结构域都可以介导体外相分离发生。为了更好地了解体内PodJ相分离的结构域,研究团队在大肠杆菌中表达了多个PodJ蛋白变体,观察其在细胞内的蛋白定位和积累情况,并使用FRAP分析了其流动性。结果显示,仅有CC4-6能够形成细胞区室化并展现出一定的流动性。这些结果说明,CC4-6或IDR均可在体外驱动PodJ 相分离,而在细胞内,PodJ相分离可能依赖于CC4-6和IDR共同起作用。通过在大肠杆菌中共表达信号功能蛋白和PodJ变体蛋白,发现IDR负责PleC和CpaE的招募,而CC4-6负责与FliG的相互作用。PodJ的体外相分离试验进一步证实了这一点(图3)。这些结果说明,PodJ驱动的细胞区室化可能直接介导了对细胞信号功能蛋白的招募,从而在细胞新极的组织和构建过程中发挥作用。
三、揭示对脚手架蛋白PodJ相分离的调控机制
在真核细胞中,不对称分配复合物之间往往存在着相互的抑制性调节,这对于细胞极性的稳态建立同样至关重要。研究团队推测,原核细胞中的细胞极性调控可能也存在着类似机制。为此,研究团队从11个新月柄杆菌极性蛋白中,筛选到一个细胞旧极脚手架蛋白SpmX,发现其调节了PodJ在大肠杆菌的极性积累。在新月柄杆菌中,SpmX的存在负调节了PodJ细胞区室化形成。进一步在体外进行分析发现,SpmX不仅可以直接抑制PodJ液滴的形成,并且可以覆盖在PodJ液滴的表面,从而抑制液滴的生长并加速液滴的老化,造成对PodJ凝聚体动力学和稳定性的损害(图4)。这些体外和体内观察结果表明,新月柄杆菌的新、旧细胞极重塑可能是由SpmX对PodJ相分离的抑制性调控作用所驱动的。
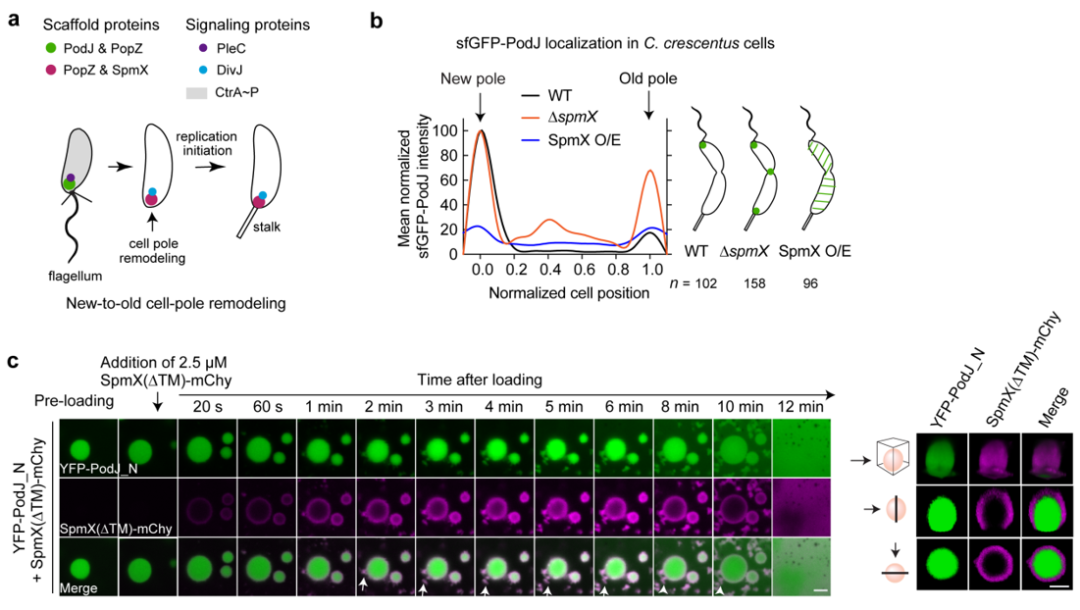
图 4. SpmX负调控PodJ相分离。a. 新月柄杆菌细胞新、旧极重构示意图;b. SpmX负调控PodJ细胞区室化;c. SpmX抑制PodJ相分离。
总结与展望
该工作提出了一种新的微生物细胞极性构建和动态调控机制,该机制涉及细菌新细胞极组装和新、旧细胞极重塑(图5)。论文阐述了天然蛋白通过相分离形成无膜区室的分子基础,解析了细胞区室化的生理功能及动态调节,证实了相分离作为组装微生物细胞极性枢纽和调节不对称细胞分裂的关键作用。通过对比原核和真核细胞,研究团队预测相分离可能作为一种通用的生物物理机制在细胞极性发育过程起调控作用。而且,对相分离及其互作组分进行功能解析,有助于进一步人工设计、合成相关元件,并为人工无膜细胞器和单细胞生命从头合成的实现打下基础。
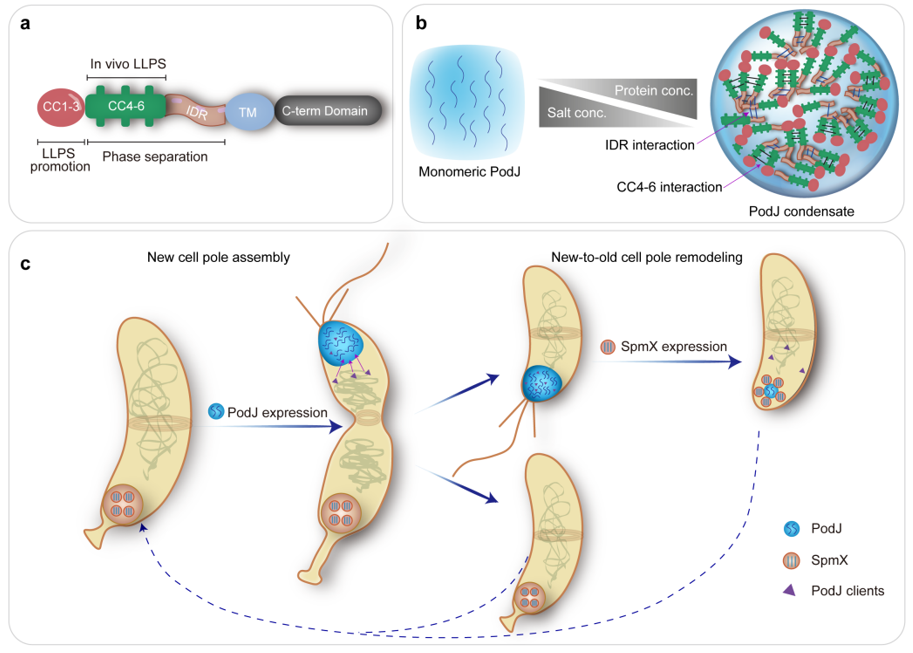
图5. 脚手架蛋白调控微生物细胞极性示意图。a. PodJ结构和功能域示意图;b. PodJ相分离特征示意图;c. PodJ和SpmX共同调节新月柄杆菌细胞极组织和形成。
中科院深圳先进院博士后谭为为论文第一作者、博士后程思华和助理研究员李莹莹为论文共同第一作者,赵维副研究员为论文通讯作者,深圳先进院为论文第一完成单位和第一通讯单位。该研究得到了钟超教授和娄春波教授的宝贵建议,并获得了国家委、国家重点研发计划、中科院战略性先导科技专项、广东省基础与应用基础研究基金委和深圳市合成生物学创新研究院的资助。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 3000余人追踪35年!JAMA子刊:心血管病发前12年身体活动已下滑,发病后运动量暴跌78% (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















