2022年FDA批准的新药 |
 |
来源:医药魔方 2023-01-05 09:53
2022年,FDA的药品评价与研究中心(CDER)共批准了37款新药,包括22款新分子实体和15款生物制品。此外,生物制品评价和研究中心(CBER)还批准了2款疫苗、1款细胞疗法和4款基因疗法2022年,的药品评价与研究中心(CDER)共批准了37款新药,包括22款新分子实体和15款生物制品。此外,生物制品评价和研究中心(CBER)还批准了2款疫苗、1款细胞疗法和4款基因疗法,以及1款微生物组疗法。
与往年相比,今年FDA批准的新药数量有所下降,但创新含量极高,获批生物制品类型丰富,涉及单抗、双抗、ADC、TCR疗法、酶替代疗法等。
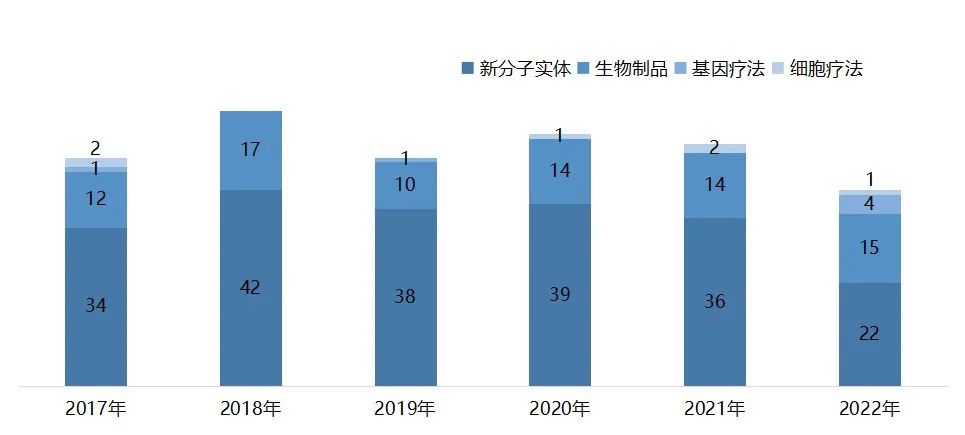
近些年FDA批准的新药数量
从疾病领域上看,2022年FDA批准的新药(不包括疫苗、基因疗法和细胞疗法)中肿瘤药占比最高(27%),其次是神经系统类和皮肤类药物。
从审评方式上看,这些新药中有13款新药通过优先审评的方式上市,还有5款通过加速批准程序上市,其中有18款被FDA授予孤儿药资格,占比高达49%,13款获得突破性疗法认定。
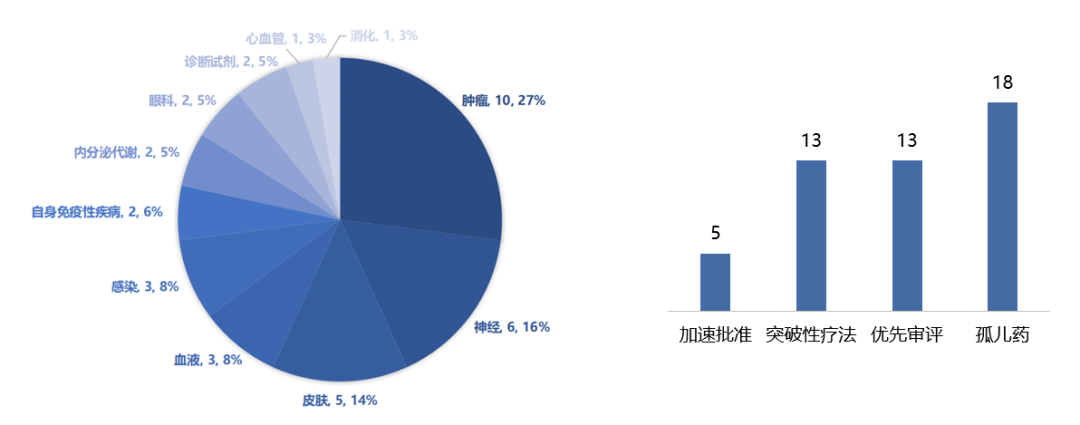
CDER批准药物疾病领域分布(左)和授予的资格认定数量(右)
从创新性上看,FDA批准的37款新药中有21款为 first-in-class 疗法,占比57%,其中10款同时获得了FDA的突破性疗法认定。10款获FDA突破性疗法认定药物
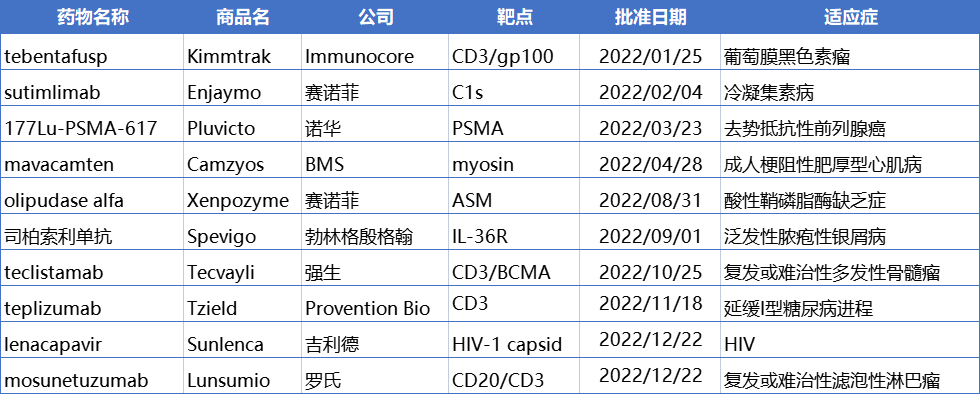
从公司上看,BMS是2022年度新药获批的最大赢家,将3款新药收入囊中,包括黑色素瘤药物Opdualag(nivolumab + relatlimab)、肥厚型心肌病药物Camzyos(mavacamten)和银屑病药物Sotyktu(氘可来昔替尼)。罗氏、赛诺菲也各自收获了2款新药。
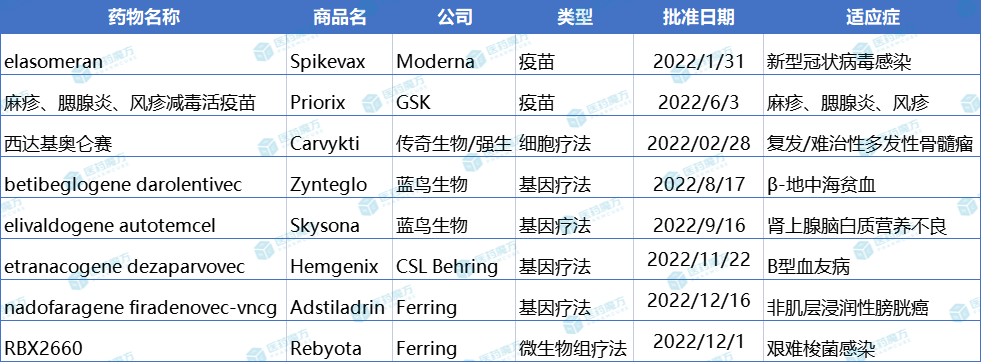
2022年FDA批准的基因疗法数量空前,高达4款,多以罕见病治疗为主。由于罕见病人群狭窄,叠加成本高等因素,蓝鸟生物的Zynteglo在美国定价280万美元,Skysona定价300万美元,CSL Behring的Hemgenix定价更是达到了350万美元,成为全球最贵的药物。
除了基因疗法,FDA还批准了1款细胞疗法、1款微生物组疗法和2款疫苗,其中细胞疗法来自于中国本土企业传奇生物,也是首款获得FDA批准的国产疗法。
CBER批准的8款新疗法
 由于篇幅有限,本文在此挑选10款重磅新药进行介绍。
由于篇幅有限,本文在此挑选10款重磅新药进行介绍。
全球首款TCR疗法:Kimmtrak
适应症:HLA-A*02:01阳性成人转移性葡萄膜黑色素瘤
1月25日,FDA批准创新双特异性融合蛋白Kimmtrak(tebentafusp-tebn)上市。这是FDA批准的首款治疗不可切除或转移性葡萄膜黑色素瘤的疗法,也是首款获批的T细胞受体(TCR)疗法,以及首款治疗实体瘤的双特异性T细胞衔接蛋白。
Tebentafusp是基于Immunocore核心技术平台ImmTACs开发的首个生物制剂,该蛋白一端是由工程化改造的高亲和力T细胞受体(TCR)结合域,可以靶向肿瘤细胞表面的gp100;另一端是靶向T细胞表面CD3的单链抗体片段(scFv)组成。
TCR结构域首先识别并结合到肿瘤细胞表面peptide-HLA。然后,抗CD3抗体片段招募并重定向T细胞至肿瘤细胞周围。这样,ImmTACs就架起了癌症细胞和T细胞之间的一座桥梁,形成突触, 激活T细胞并释放溶解性颗粒,导致癌症细胞死亡。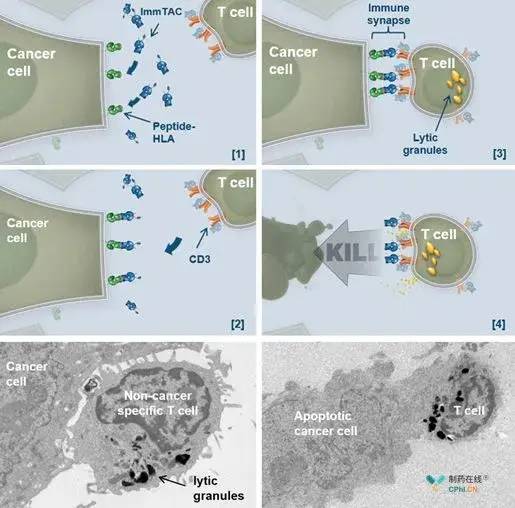 Tebentafusp杀死癌细胞过程
Tebentafusp杀死癌细胞过程
首个国产CAR-T细胞疗法:Carvykti
适应症:复发/难治性多发性骨髓瘤
2月28日,传奇生物和强生合作开发的BCMA CAR-T疗法Carvykti(cilta-cel)获FDA批准上市。这是首款获得FDA批准的国产CAR-T疗法。此次获批也是继百济神州泽布替尼之后中国创新药国际化取得的新里程碑和新突破。
Cilta-cel由金斯瑞旗下子公司传奇生物自主研发,是一种结构差异化的CAR-T细胞疗法,包含一个4-1BB共刺激结构域和两个旨在提高亲和性的BCMA靶向单域抗体。该药物曾先后获得FDA的突破性疗法认定和优先审评资格,EMA的优先药物资格,同时也是中国首个获得突破性疗法资格的药物。就在2022年12月底,该产品也向CDE递交了上市申请。
近10年来首款新药物类型:Mounjaro
适应症:辅助饮食和运动,改善成人2型糖尿病患者的血糖控制
5月13日,FDA批准礼来葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂Mounjaro(tirzepatide)上市。礼来表示,这是近10年来首个新糖尿病药物类型。
Tirzepatide是每周注射一次的GIP和GLP-1受体激动剂,将两种肠促胰岛素的作用整合到一个新分子中。GIP是一种激素,可以补充GLP-1受体激动剂的作用。临床前模型已证明GIP可以减少食物摄入并增加能量消耗,从而使体重减轻。并且GIP与GLP-1受体激动剂联合使用时,可能会对患者血糖和体重产生更大的影响。
25年来首款银屑病外用新药:Vtama
适应症:局部治疗成人斑块型银屑病
5月23日,FDA批准Vtama(本维莫德,tapinarof,1%)乳膏治疗成人斑块型银屑病。这是FDA批准的同类中首个也是唯一一个无类固醇的外用药物,也是美国25年来获批治疗银屑病的首款外用新分子实体药物。
本维莫德是一款新型、每日1次的治疗性芳香烃受体调节剂(TAMA),是一种非类固醇外用乳膏。它由本土企业天济医药研发,是我国具有自主知识产权的(first-in-class)全球创新药。2012年,GSK以近2亿美元的首付款获得本维莫德境外开发权,2018年7月,GSK以3.3亿美元的价格将本维莫德境外开发权出售给Dermavant公司。
全球首款TYK2抑制剂:Sotyktu
适应症:斑块状银屑病
9月9日,BMS的TYK2抑制剂氘可来昔替尼(deucravacitinib)治疗斑块状银屑病的上市申请获FDA批准。这是全球首款获批上市的TYK2抑制剂,已在国内申报上市。
氘可来昔替尼是一款具有独特作用机制的口服高选择性酪氨酸激酶2(TYK2)变构抑制剂。其通过选择性靶向TYK2抑制参与多种免疫介导疾病发病机制的关键细胞因子(如IL-23、IL-12和I型干扰素)的信号传导。氘可来昔替尼通过与TYK2的调节结构域结合实现高度选择性,促成TYK2及其下游功能的变构抑制。在生理浓度范围内,氘可来昔替尼选择性地抑制TYK2,且在治疗剂量下不抑制JAK1、JAK2或JAK3。
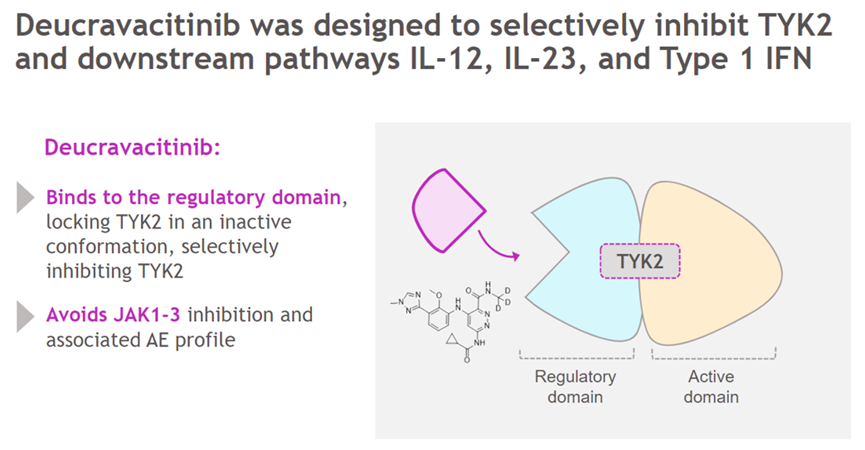 Deucravacitinib作用机制
Deucravacitinib作用机制

- 相关报道
-
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 3000余人追踪35年!JAMA子刊:心血管病发前12年身体活动已下滑,发病后运动量暴跌78% (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















