首次解析!Cell: 斯坦福科学家利用类器官精准定位新冠病毒进出鼻腔细胞的途径 |
 |
来源:100医药网 2023-01-16 11:43
使用鼻喷剂或者其他预防性的短期药物来延迟病毒的进入、退出或传播,而这将有助于免疫系统及时赶上和到达,以阻止全面的感染发生。 大家都知道这场持续了三年之久的疫情是由新型冠状病毒引起的,可能还有些人了解新冠病毒是一个单链RNA病毒,它是使用自己的刺突蛋白,与细胞上的紧张素转化酶酶2(简称ACE2)受体结合来完成识别的,接着病毒就会进入宿主细胞并开始复制,最终引发疾病。但病毒究竟是如何进入呼吸系统的,病毒进入呼吸道上皮细胞以及如何在细胞间传播的分子机制尚不清楚。 2023年1月5日,来自斯坦福大学的科研团队在著名期刊Cell杂志在线发表了一篇名为《SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming》的研究文章,这项研究首次详细阐述了新冠病毒感染呼吸道上皮细胞的分子机制,研究人员发现病毒通过ACE2受体附着在上皮细胞的纤毛上,并且使用纤毛作为进入细胞的通道。
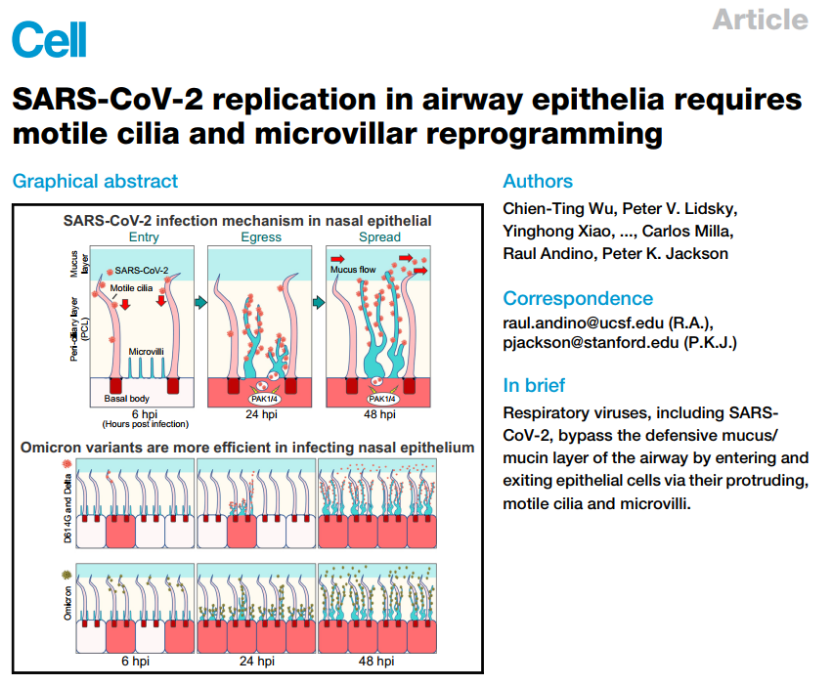 鼻子是上呼吸道粘膜的重要组成部分,它参与宿主保护的免疫稳态。鼻粘膜防御主要有两种类型,从生理角度上来说,由紧密结合的纤毛细胞、杯状细胞和基底上皮细胞、双层黏液层和基底膜构成的屏障是最主要的防御手段,但我们还不清楚哪些类型的细胞最先被感染。
作者首先利用原代细胞培养分化的手段生成了纤毛细胞、杯状细胞和基底细胞的鼻上皮类器官,这种类器官包括了正常人上气道上皮的形态和功能,接着用新冠病毒去感染培养的类器官,结果发现新冠病毒核衣壳蛋白和刺突蛋白只有在感染后的6、24 和 48 小时的时候在纤毛细胞中可见,这表明纤毛细胞更加容易被早期感染,因此,纤毛细胞是SARS-CoV-2在鼻上皮中的主要进入部位。
鼻子是上呼吸道粘膜的重要组成部分,它参与宿主保护的免疫稳态。鼻粘膜防御主要有两种类型,从生理角度上来说,由紧密结合的纤毛细胞、杯状细胞和基底上皮细胞、双层黏液层和基底膜构成的屏障是最主要的防御手段,但我们还不清楚哪些类型的细胞最先被感染。
作者首先利用原代细胞培养分化的手段生成了纤毛细胞、杯状细胞和基底细胞的鼻上皮类器官,这种类器官包括了正常人上气道上皮的形态和功能,接着用新冠病毒去感染培养的类器官,结果发现新冠病毒核衣壳蛋白和刺突蛋白只有在感染后的6、24 和 48 小时的时候在纤毛细胞中可见,这表明纤毛细胞更加容易被早期感染,因此,纤毛细胞是SARS-CoV-2在鼻上皮中的主要进入部位。

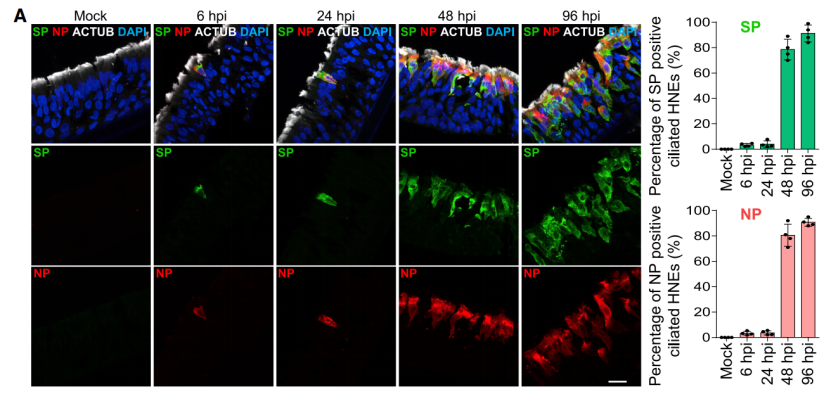
图一:新冠病毒首先感染纤毛细胞1
由于ACE2 和 TMPRSS2 是 SARS-CoV-2 感染的核心,并定位于呼吸道纤毛细胞上,通过染色定位实验作者发现这两种关键的受体蛋白在培养的类器官上也有同样的定位,因此作者假设SARS-CoV-2和其他呼吸道病毒通过ACE2附着在纤毛上以穿透PCL,并使病毒能够通过粘液蛋白层运输。我们刚刚提过黏液层是维持免疫稳态的一种重要的免疫屏障,因此研究人员用一种黏蛋白特异性的酶处理类器官,这种酶可以分解黏蛋白形成的网络结构,结果发现这加速了病毒的感染速度。

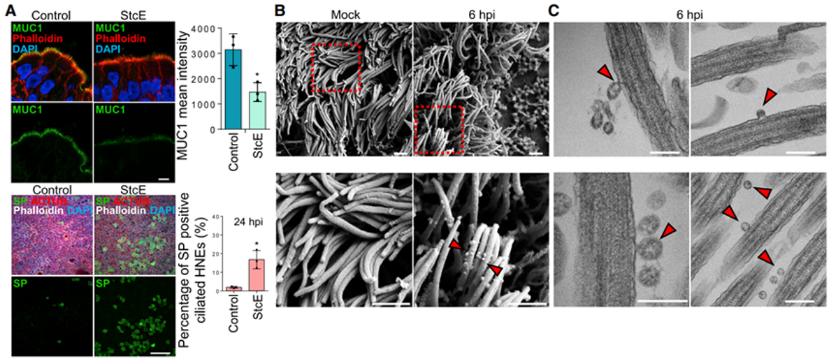
图二:SARS-CoV-2在感染的初始阶段附着在纤毛上1
为了测试SARS-CoV-2是否在早期特异性的结合纤毛细胞,作者利用扫描和透射电子显微镜观察感染了病毒的类器官,结果证实多个病毒粒子附着在纤毛上,这表明纤毛被 SARS-CoV-2利用以穿过鼻上皮屏障。通过重组刺突蛋白与荧光偶联,并用延时显微镜观察说明SARS-CoV-2与纤毛ACE2受体结合以促进细胞进入。
基于以上的实验结果,作者假设减少纤毛的数量会阻碍病毒感染的进程,通过敲低对纤毛细胞形成至关重要的CEP83蛋白(不影响上皮或杯状细胞的分化),作者发现CEP83下调的确抑制了24和48hpi的类器官SARS-CoV-2感染水平。
进一步的,为了更好地了解鼻上皮中的病毒感染,作者探究了病毒从少数最初感染的细胞中排出的情况,结果发现病毒感染促进了细胞丝状伪足突起,诱导含病毒的丝状伪足可能对SARS-CoV-2的释放和后代病毒粒子在细胞间传播很重要。因此,作者使用透射电镜和IF染色系统地展示了原代气道上皮细胞中的微绒毛样结构。在纤毛状类器官的顶端表面上观察到两类突起:长而宽的活动纤毛和粗短的圆顶状微绒毛(图3A),接下来,通过共聚焦和免疫组化实验作者证明了SARS-CoV-2与微绒毛相互作用,使其能在受感染动物的呼吸道内传播。
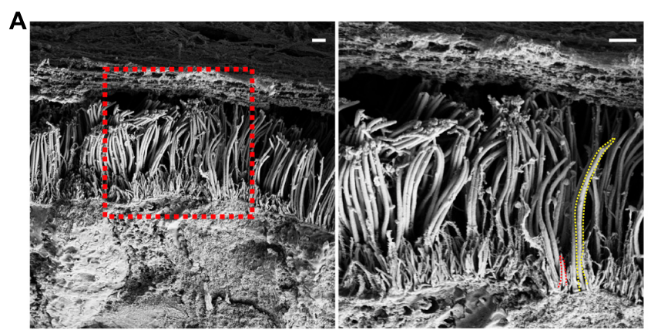

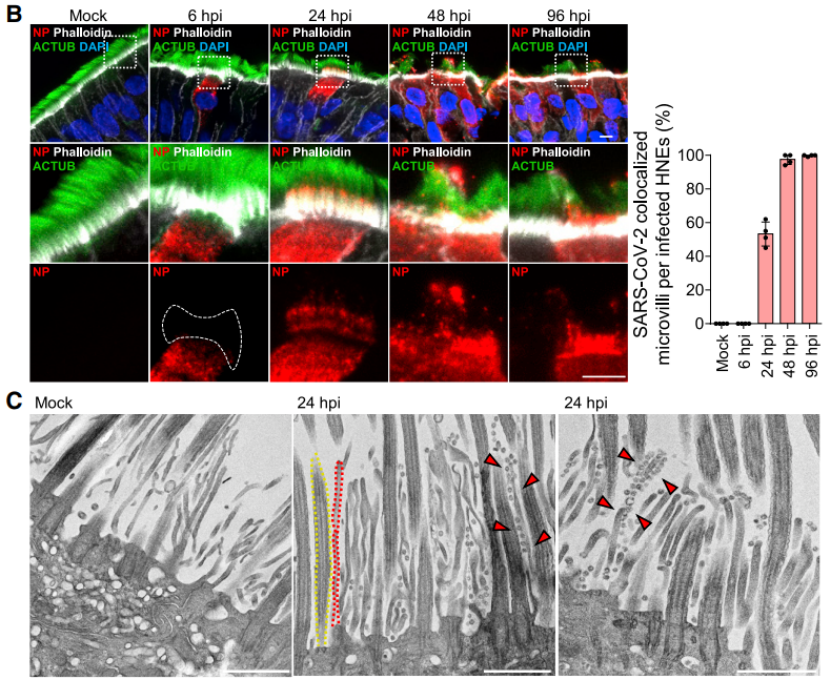
图三:SARS-CoV-2在感染后期与微绒毛共定位1
而进一步的研究表明SARS-CoV-2使微绒毛发生延伸,通过调节微绒毛的结构和功能,通过促进高度延伸和分支的微绒毛的形成来促进病毒的排出。
原发性纤毛运动障碍(PCD患者),这是一种罕见的常染色体隐性遗传病,虽然呼吸道纤毛的数量和长度是正常的,但是失去了纤毛摆动和病原体清除的功能。通过使用患者的类器官培养物,作者发现在患者和健康供体中 24 hpi 时 SARS-CoV-2 感染细胞的百分比相似,这表明突变不会影响初始感染率,然而,在 48 hpi 时,PCD 患者的SARS-CoV-2感染细胞少于健康供体,这表明其在感染后期很重要。
除此之外,作者还探讨了细胞间的接触是否影响病毒的转移。我们知道呼吸上皮由多层细胞组成,然而,直到48 hpi时,只有最上层的细胞被病毒感染,下层的细胞很少被感染。因此,细胞间接触可能不是病毒在鼻上皮中传播的唯一途径。虽然病毒可能通过鼻上皮的细胞间接触传播,但作者认为传播取决于顶端表面的粘液流动。
鉴于在细胞中调节激酶能够控制细胞骨架的生成,作者探究了是哪些激酶被调控后促进了微绒毛的高度延伸,通过磷酸化蛋白质组学的手段,作者最终确定了五种激酶,包括细胞骨架重组p21活化激酶1和4(PAK1和PAK4),丝氨酸/苏氨酸激酶(AKT1/2),丝裂原活化蛋白激酶(p38)、丝裂原活化蛋白激酶(ERK1)和含有蛋白激酶1的ROCK1。作者确定这些激酶是否在感染细胞中磷酸化,所有五种药物均在类器官中被激活。 在动物实验中,研究人员采用鼻喷雾剂将SLK和PAK4激酶抑制剂应用于K18-hACE2转基因小鼠,结果PAK4激酶抑制剂可以部分抑制感染的水平,这为开发鼻腔喷雾剂来预防病毒感染提供了借鉴的范例。 总的来说,作者发现新冠病毒会首先感染呼吸道纤毛细胞,如果移除纤毛,则可阻止新冠病毒和其他呼吸道病毒的感染,同时,侵入的病毒会激活细胞中激酶来促进细胞骨架的形成,通过高度延伸的微绒毛结构将新生成的病毒送到黏液层,从而提高了病毒的传播能力。事实上,并不是只有新冠病毒会通过这种方式进行传播,其他呼吸道病毒也可能通过同样的方式突破免疫屏障,就新冠病毒本身而言,大体来说,抗新冠病毒的药物可以归纳为两大类,一是阻止病毒和宿主细胞结合,二是阻止新病毒在宿主细胞内的产生,但是本项研究提出了一个新的预防性策略,那就是使用鼻喷剂或者其他预防性的短期药物来延迟病毒的进入、退出或传播,而这将有助于免疫系统及时赶上和到达,以阻止全面的感染发生。
参考文献:
1.Wu CT, Lidsky PV, Xiao Y, Cheng R, Lee IT, Nakayama T, Jiang S, He W, Demeter J, Knight MG, Turn RE, Rojas-Hernandez LS, Ye C, Chiem K, Shon J, Martinez-Sobrido L, Bertozzi CR, Nolan GP, Nayak JV, Milla C, Andino R, Jackson PK. SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming. Cell. 2023 Jan 5;186(1):112-130.e20.
2.Hellings PW, Steelant B. Epithelial barriers in allergy and asthma. J Allergy Clin Immunol. 2020 Jun;145(6):1499-1509. 3.Gallo O, Locatello LG, Mazzoni A, Novelli L, Annunziato F. The central role of the nasal microenvironment in the transmission, modulation, and clinical progression of SARS-CoV-2 infection. Mucosal Immunol. 2021 Mar;14(2):305-316. 医药网新闻
- 相关报道
-
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 3000余人追踪35年!JAMA子刊:心血管病发前12年身体活动已下滑,发病后运动量暴跌78% (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















