袁进教授团队建立工程化外泌体可溶性微针角膜炎症干预新策略 |
 |
来源: 中山眼科中心 2024-09-19 13:06
该研究通过构建aT-Exo,靶向抑制角膜碱烧伤引起的炎症反应,促进角膜的修复和再生,结合构建的PVA-MNs实现外泌体的精确和持续角膜递送。角膜是维持清晰视觉的前提和基础,化学性外伤、性疾病引起的炎症反应导致伤口愈合延迟,破坏角膜正常结构与功能,严重者如角膜碱性化学伤导致失明,严重威胁患者视力健康。现有的临床治疗方法存在诸多局限性,促使研究者不断探索高效、安全的创新疗法。
近期,中山大学中山眼科中心袁进教授团队,成功构建了具有靶向抗炎作用的工程化外泌体,创新性的与可溶性微针给药体系相结合,显著抑制角膜碱烧伤导致的炎症反应,改善角膜碱烧伤预后。研究成果近日以题为 Engineered Mesenchymal Stromal Cell Exosomes-Loaded Microneedles Improve Corneal Healing after Chemical Injury 发表在国际知名学术期刊ACS Nano。
研究团队通过基质金属蛋白酶(MMPs)可切割肽链将抗TNF- 抗体(aT)连接于脂肪间充质外泌体(ADSC-Exo)表面构建工程化外泌体(aT-Exo),通过电镜、免疫荧光共定位、纳米流式及Zeta电位检测等方法检测aT-Exo的特征(图1)。

图1. aT-Exo的构建、形貌及性能表征
构建小鼠角膜碱烧伤模型,结膜下注射aT-Exo,动态分析证实抗TNF- 抗体修饰的工程化外泌体制备技术,提高aT利用率同时,增强外泌体抗炎特异性,显著下调碱烧伤角膜炎症损害并促进角膜损伤修复(图2)。
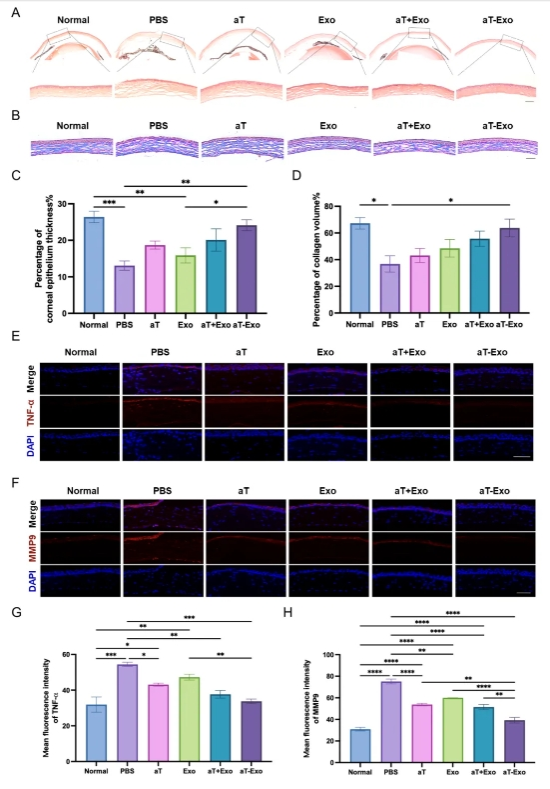
图2. aT-Exo通过抑制炎症减轻角膜化学损伤
在角膜上皮细胞与M1型巨噬细胞共培养体系中,aT-Exo可以通过促进巨噬细胞M2型极化,显著降低共培养体系中的TNF- 、MMP9、IL-6和IL-1 表达(图3)。

图3. aT-Exo通过抑制炎症因子的释放保护角膜上皮细胞
为了克服传统眼局部给药,组织穿透性和生物利用度低的局限性,研究团队采用聚乙烯醇(PVA)构建微针(MNs)阵列,实现工程化外泌体跨角膜上皮递送。显示载外泌体微针具有足够的强度有效穿进角膜基质层,相比于传统给药方式,MNs具有更高的角膜药物利用率和更长的药物释放时间,实现外泌体的靶向递送(图4)。
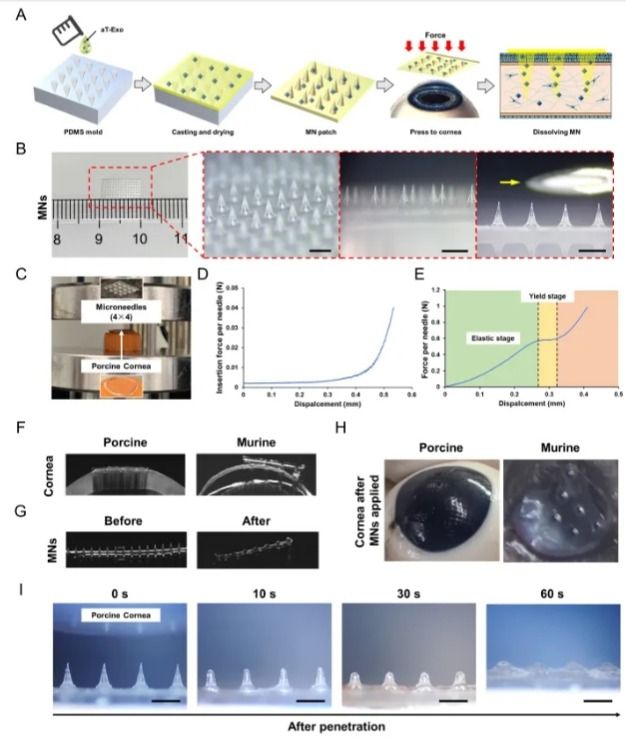
图4.MNs的构建和跨角膜上皮药物递送评价
小鼠角膜碱烧伤动物模型中,aT-Exo分别通过滴眼液(E-Drop)、结膜下注射(E-Conj)和微针(E-MN)形式进行给药,结果显示MNs递送系统能够有效提高外泌体的生物利用度,增强角膜炎症控制效果(图5)。
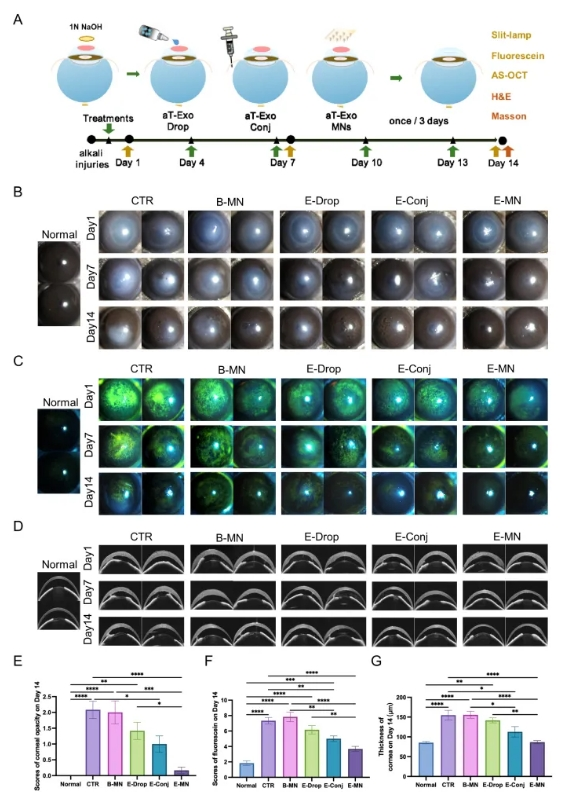
图5. MNs递送aT-Exo干预小鼠角膜碱烧伤
该研究通过构建aT-Exo,靶向抑制角膜碱烧伤引起的炎症反应,促进角膜的修复和再生,结合构建的PVA-MNs实现外泌体的精确和持续角膜递送,展示了工程化外泌体干预角膜炎症相关疾病的临床应用前景,同时证实微针技术在眼部生物活性纳米药物递送中的潜力 (图6) 。
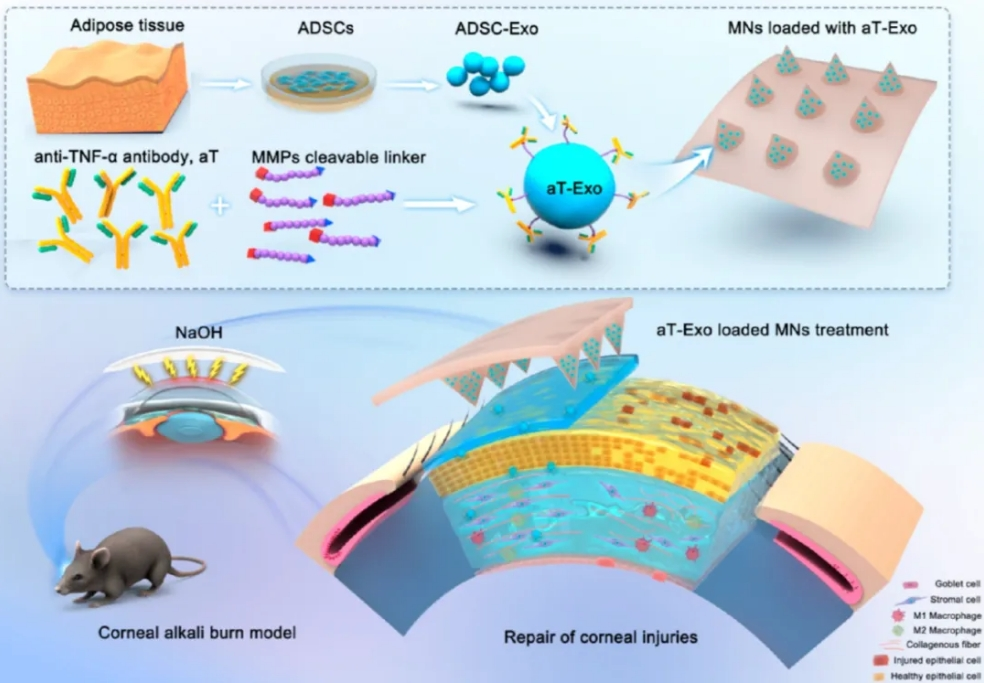
图6. 装载工程化外泌体(aT-Exo)的微针体系效果机制模式图
中山大学中山眼科中心、眼病防治全国重点实验室为第一单位,中山眼科中心袁进教授、李赛群副主任医师和香港大学刘璐教授为共同通讯作者,中山眼科中心余菲博士后、赵轩副研究员和汪倩博士后为共同第一作者。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 减肥抗癌踩坑了?Cancer & Metabolism揭秘:血脂才是乳腺癌“燃料”,体重数字说了不算 (2025-10-20)
- Cell重磅:发现肿瘤“破防区”,T细胞由此进入,促进免疫治疗成功 (2025-10-20)
- 黄曦教授团队开发创新性吸入式细胞疗法为攻克肺转移癌提供新策略 (2025-10-20)
- 登上Cancer Cell封面:中国创新“双免疫检查点抑制”疗法,改变结肠癌治疗策略 (2025-10-20)
- Science :“一吻,一缩,一溜烟”——颠覆教科书的神经信号传递新机制 (2025-10-20)
- Sci Adv:破解白血病耐药谜题——癌细胞竟用“变形线粒体”逃逸治疗 (2025-10-20)
- 从“缺血管少免疫”到“全真模拟”! Sci Adv:PDMS微孔平台构建含血管+小胶质细胞的视网膜类器官,破解眼病研究困局 (2025-10-20)
- Nature:人类肠道中的“病毒卫士”——温和噬菌体的神秘面纱被揭开! (2025-10-20)
- Nature Medicine:生命之初的“无声告别”——解密反复IVF失败背后的遗传密码 (2025-10-19)
- 北京林业大学发表最新Science论文 (2025-10-19)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















