《科学·转化医学》:找到了清除靶向治疗残留耐药癌细胞的方法 |
 |
来源:奇点蛋糕2022-05-05 14336026
与“杀敌一千自损八百”的化疗不同,癌基因靶向治疗因其对致癌靶点的精准作用,被称为“生物导弹”。
与化疗杀敌1000,损敌800不同,癌基因的靶向治疗因作用于致癌靶点而被称为生物导弹。
近年来,多种靶向治疗药物已成功应用于临床。但癌症晚期患者的实际获益并不理想,其中一个重要原因就是耐药性。然而,我们对靶向耐药的机制知之甚少。
研究发现,靶向治疗存活下来的残留癌细胞以及随后的DNA损伤修复是肿瘤细胞产生耐药性的重要原因[1]。因此,探索靶向治疗诱导的DNA损伤修复相关分子,阐明肿瘤耐药机制,对于靶向药物的研发和临床方案的选择具有重要意义。
最近,杜克大学的Kris C. Wood博士及其团队发现,在靶向治疗中存活下来的肿瘤细胞中存在DNA双链断裂(DSB)和DNA双链断裂修复,而这种修复过程依赖于共济失调毛细血管扩张突变(ATM)酶。
他们还发现,靶向治疗药物和ATM抑制剂的联合应用可以在体外和动物模型中根除残留的肿瘤细胞,进而产生更持久的治疗反应[2]。
这一研究结果为ATM抑制剂的临床研发与现有靶向治疗方案的整合奠定了理论基础。相关研究成果近日发表在著名期刊《科学 转化医学》(科学转化医学)上。

论文的第一页
接下来,我们来看看这个研究是如何进行的。
首先,为了研究靶向治疗能否激活DNA损伤反应信号通路(DDR),研究小组使用了一组对同源靶向治疗敏感的肿瘤细胞系:表皮生长因子受体(EGFR)突变非小细胞()细胞系(PC9,HCC827)、间变性激酶(ALK)基因重排NSCLC细胞系(H3122)、BRAF突变黑色素瘤细胞系(A375)、FLT3突变急性髓系细胞系(MOLM13)、KRAS突变细胞系(MIA PaCa-2)和NSCLC细胞系(A549)。
他们发现,用不同剂量的同源靶向治疗药物处理上述细胞系24小时后,S1981位点磷酸化ATM(p-ATM)和H2AX的表达显著增加。需要指出的是,ATM S1981位点的磷酸化是激活下游DNA损伤反应信号通路的必要位点,H2AX(组蛋白H2A家族X成员)磷酸化产生的H2AX是DNA双链断裂的生物标志物。
下面的细胞克隆形成实验表明,在不影响细胞生存力的药物剂量下,H2AX的表达仍然显著增加。这一结论在三种吉非替尼耐药的EGFR突变型NSCLC细胞系(PC9R、GR4、WZR12)中得到进一步验证。同时,在用靶向药物处理的PC9和A549细胞中观察到阴性膜联蛋白V染色(用于检测凋亡)。
最后,中性彗星试验(一种在单细胞水平检测DNA损伤的技术)发现,PC9和A549细胞用靶向药物处理24小时后,检测到DNA双链断裂的存在,表明观察到的ATM激活是由DNA损伤引起的。
这些结果表明,DNA双链断裂和随后的ATM激活将发生在靶向治疗存活的肿瘤细胞中。
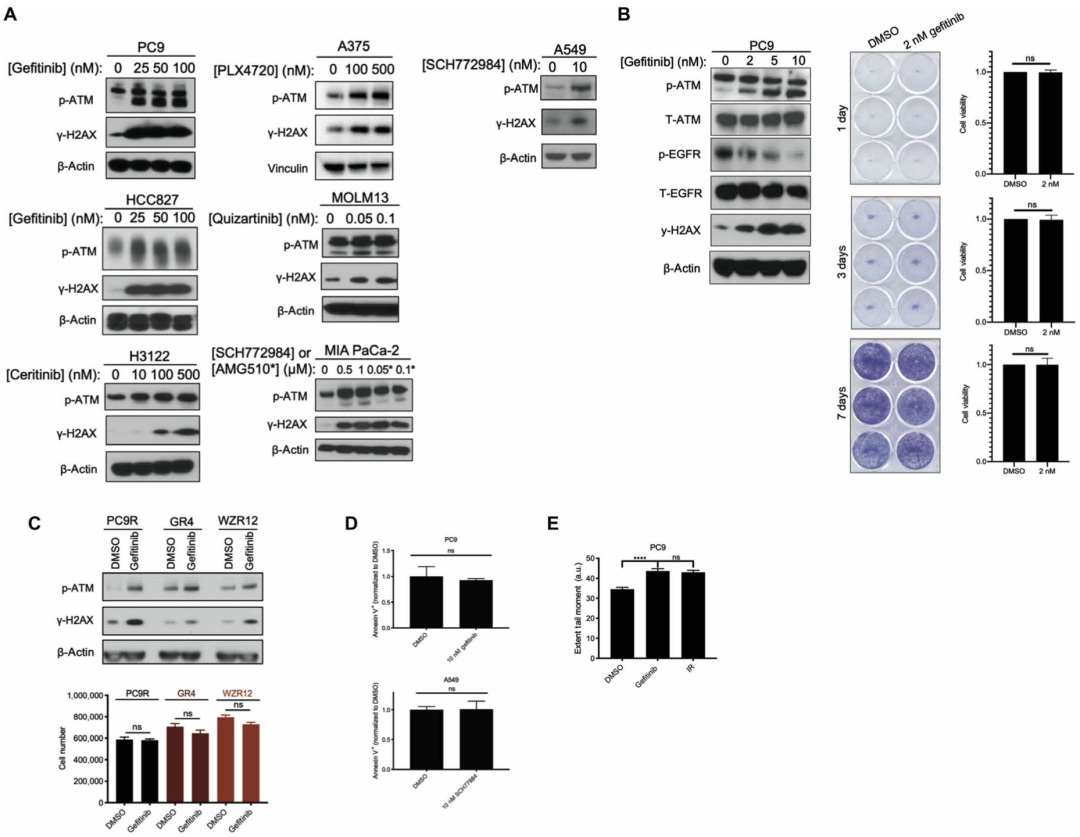
DNA损伤反应信号通路在靶向药物治疗的肿瘤细胞中被激活。
那么,ATM是如何激活的呢?我们继续往下看。
首先,在用吉非替尼(EGFR阻断剂)处理PC9和HCC827细胞24小时后,激酶2 (CHK2)的T68位点在ATM及其底物检查点的磷酸化表达增加。随后,研究人员用ATM激酶抑制剂(AZD0156)单独或与吉非替尼联合处理PC9细胞,发现AZD0156和吉非替尼联合可以消除H2AX的表达和DNA双链断裂修复途径的激活。
在接下来的实验中,研究人员发现,随着吉非替尼剂量的增加和处理时间的延长,p-ATM和H2AX的表达逐渐增加,9(起始子caspase 9和执行者caspase 3都被切割。
最近的一项研究表明,内源性caspase的激活可以导致DNA双链断裂的形成以及ATM的后续激活[3]。因此,研究人员假设,Bcl-2抗凋亡家族成员BIM和BAK/BAX对下游caspase的激活,以及由此导致的线粒体外膜通透性(MOMP)的增加,可能是DNA双链断裂和ATM激活的原因。
为了验证这一假设,他们敲除了PC9细胞中BIM和BAX的表达,发现BIM和BAX的低表达可以消除靶向治疗诱导的ATM和H2AX的激活。为了进一步验证这一假设,研究人员用泛素抑制剂(Q-VD-OPh)单独或与吉非替尼联合治疗PC9细胞,发现两者的联合可以消除仅使用吉非替尼时观察到的ATM激活。
同时敲除PC9细胞中的caspase 3和caspase 7,也可以消除吉非替尼处理的PC9细胞中ATM和H2AX的激活。胱天蛋白酶激活的脱氧核糖核酸酶(CAD)是由胱天蛋白酶3和7激活的关键酶,介导DNA双链断裂。吉非替尼处理的PC9细胞中脱氧核糖核酸酶的表达是怎样的?
结果显示,脱氧核糖核酸酶的表达保持相对不变,但胱天蛋白酶激活的脱氧核糖核酸酶抑制剂(ICAD)的表达显著下降。研究人员进一步敲除了PC9细胞中脱氧核糖核酸酶的表达,发现在吉非替尼处理的PC9细胞中没有观察到H2AX的激活,但仍然观察到caspase 3的切割和脱氧核糖核酸酶抑制剂的丢失。
这些结果表明,脱氧核糖核酸酶抑制剂的低表达导致脱氧核糖核酸酶的激活,进而诱导DNA双链断裂和ATM激活,而caspase的激活和脱氧核糖核酸酶抑制剂的缺失在脱氧核糖核酸酶激活的上游发挥作用。
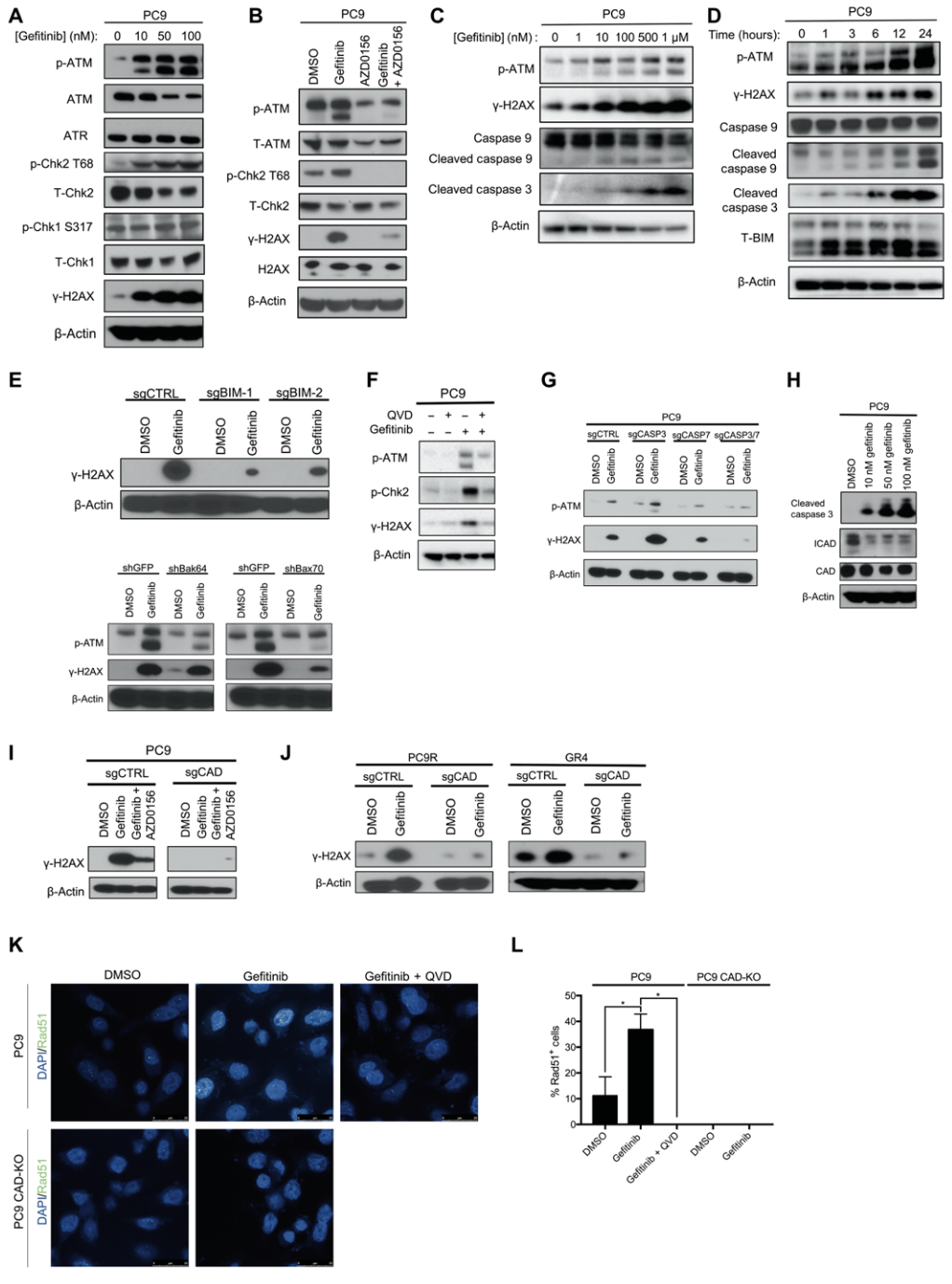
EGFR抑制剂诱导ATM信号通路的激活
这些结果表明,在靶向治疗中存活的细胞可能需要ATM激活来修复由靶向治疗暴露引起的DNA双链断裂。那么ATM抑制剂能提高靶向治疗的反应强度和持续时间吗?
首先,之前的实验已经证实AZD0156可以阻断吉非替尼诱导的ATM的激活。随后研究人员发现,AZD0156单独使用或与吉非替尼联合使用,可以增加靶向药物敏感细胞系(PC9)和靶向药物耐药细胞系(PC9R、GR4)对吉非替尼的敏感性。
这说明EGFR抑制剂治疗后残留的肿瘤细胞对EGFR抑制剂和ATM抑制剂的联合治疗仍然敏感,这种联合治疗方案可以消除EGFR抑制剂单一治疗后存活的肿瘤细胞。接下来,研究小组进一步验证了这一结论。
长期定性进展时间(TTP)分析表明,AZD0156对细胞生长影响不大,而吉非替尼单药治疗在40天左右导致肿瘤细胞耐药性增加,而吉非替尼与AZD0156联合治疗可有效清除残留肿瘤细胞,从而避免耐药肿瘤细胞的生长。
最后,研究小组评估了EGFR抑制剂和ATM抑制剂组合中脱氧核糖核酸酶对细胞反应的影响。发现在PC9和GR4细胞中敲除脱氧核糖核酸酶的表达后,联合治疗对肿瘤细胞生长的抑制作用可以逆转。接下来,在抑制ATM的表达后,发现ATM的缺失消除了吉非替尼诱导的H2AX的激活,说明AZD0156是通过靶向ATM抑制发挥作用的。
总之,这些结果表明,脱氧核糖核酸酶介导的DNA双链断裂是合成依赖于ATM的,ATM是解决EGFR抑制剂治疗存活的肿瘤细胞中这种DNA损伤的关键激酶。因此,EGFR抑制剂和ATM抑制剂的联合应用可以消除EGFR抑制剂单一治疗后存活的肿瘤细胞,进而抑制耐药肿瘤细胞的生长。
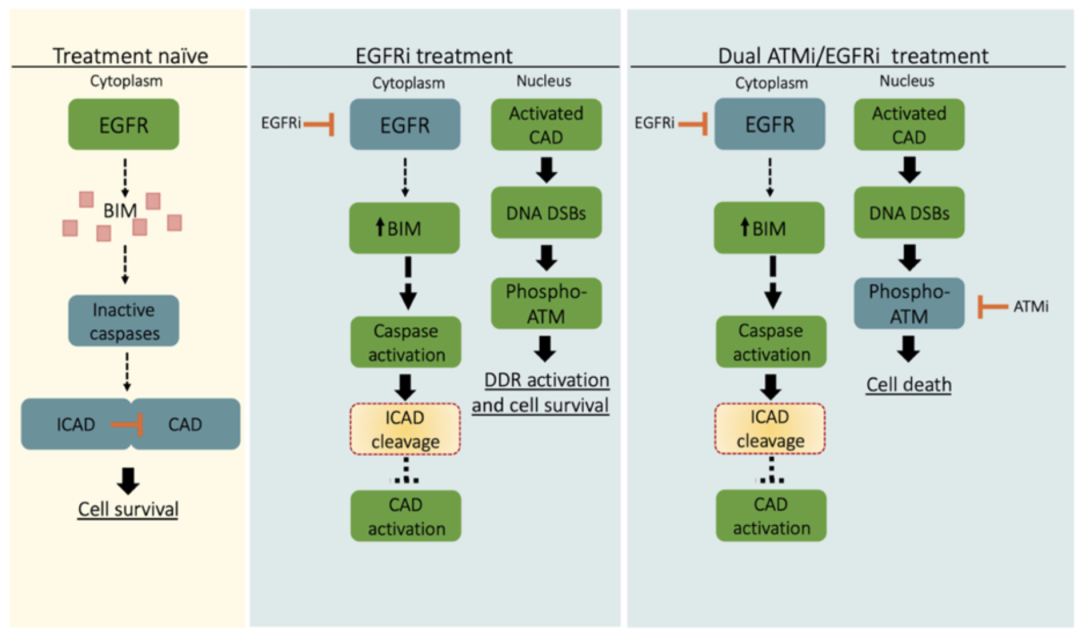
机构示意图
体外细胞实验证实,EGFR抑制剂和ATM抑制剂的联合应用可以抑制耐药肿瘤细胞的生长。那么,这种联合治疗会阻止体内肿瘤的生长吗?接下来,研究团队进行了体内异种移植实验。让我们一起来看看结果。
结果发现,单独的ATM抑制剂对肿瘤生长的影响很小,EGFR抑制剂可以在肿瘤产生耐药性之前抑制肿瘤的生长,而用ATM抑制剂和EGFR抑制剂联合治疗的小鼠在整个研究期间显示出持续的肿瘤消退。
随后,研究小组使用了从肺癌患者肿瘤组织中提取的三种细胞模型,MGH134(来自EGFR突变型非小细胞肺癌患者,并对一线厄洛替尼治疗耐药)、MGH1109(来自EGFR突变型非小细胞肺癌患者)和MGH006(来自EML4-ALK变异型1突变型非小细胞肺癌患者)进行进一步验证。
结果表明,ATM抑制剂在靶向治疗中可以抑制耐药肿瘤的生长。与这一发现一致的是,在MGH134异种移植小鼠中,oxetine的治疗产生了最初的生长抑制,然后是肿瘤进展,而oxetine和AZD0156的组合治疗产生了持续的肿瘤消退。
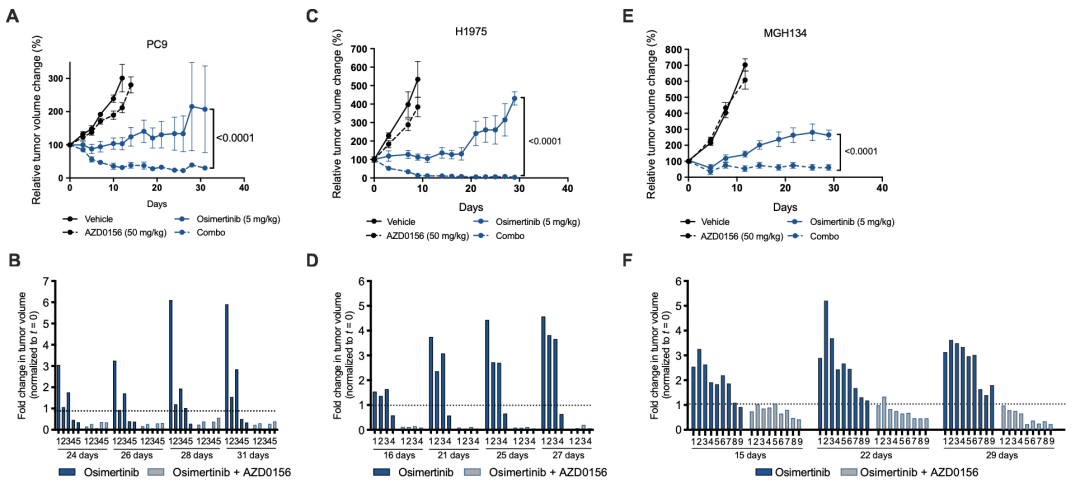
靶向治疗诱导小鼠异种移植模型中ATM的激活
最后,为了探索这些实验结果与临床之间可能的相关性,研究小组分析了接受EGFR抑制剂治疗的患者肿瘤组织中ATM的激活情况。
首先,研究人员用组织化学(IHC)对5例EGFR突变非小细胞肺癌患者的肿瘤组织进行染色。结果显示,与用EGFR抑制剂厄洛替尼治疗前相比,在治疗期间肿瘤组织中p-ATM的表达显著增加。对来自所有患者的肿瘤样本的进一步综合分析显示,用厄洛替尼治疗的进展患者的肿瘤组织中p-ATM的表达显著增加。
接下来,研究人员分析了斯隆-凯特琳可手术癌症靶点(MSK-IMPACT)临床测序队列数据库中接受一线厄洛替尼治疗的11名患者的临床进展时间数据。这11名患者同时存在EGFR突变/埃罗替尼致敏突变和ATM突变。
结果显示,有ATM缺陷突变的EGFR突变型非小细胞肺癌患者的无进展生存期长于无ATM突变的EGFR突变型非小细胞肺癌患者。在具有ATM功能障碍突变的肿瘤患者中,厄洛替尼治疗的TTP为17.810.9个月,而在具有非功能性ATM突变的肿瘤患者中,TTP为9.01.9个月。这一结果与多项研究中观察到的8至12个月的临床进展时间一致,在这些研究中,未选择的EGFR突变型NSCLC患者接受了一线厄洛替尼治疗[4]。
这些数据表明,EGFR抑制剂治疗后存活的肿瘤细胞中出现ATM激活,这可能在肿瘤中起保护作用。
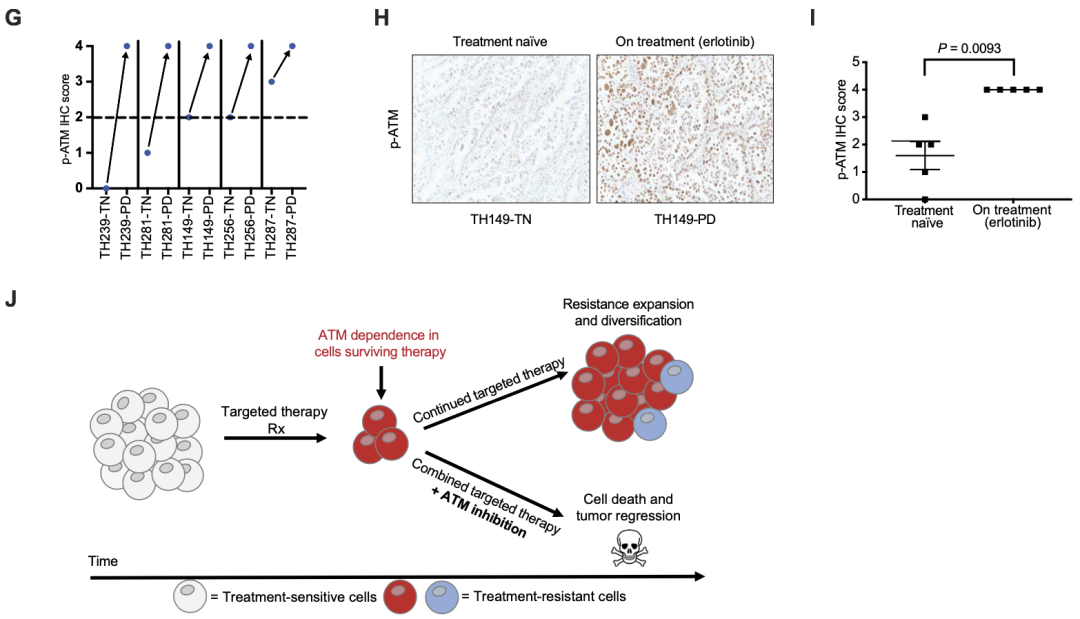
靶向治疗在患者的肿瘤组织中诱导ATM活化。
总的来说,本研究探索了靶向治疗引起耐药的分子机制,并通过体外和体内实验进一步验证了ATM抑制剂和靶向药物联合治疗对耐药肿瘤的清除作用。最后回到临床,检测了靶向前后肿瘤组织中NSCLC患者的表达,以及ATM功能性缺失突变对靶向药物疗效的影响。
本研究为ATM抑制剂与现有靶向治疗方案和临床试验设计的整合奠定了理论基础,也为临床提供了新的思路。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- 抑郁不只是“情绪感冒”!Science 子刊揭密:大脑糖链“脱落”才是关键,靶向修复或破治疗困局 (2025-10-15)
- N Engl J Med:当寂静被打破!基因疗法让遗传性耳聋儿童重闻世界之声 (2025-10-15)
- 《勇敢的心》推出第三期 对话刘建实:以心为灯,照亮医学与人性之路 (2025-10-15)
- 首儿所构建儿童安康评估系统,以数据为基守护将来 (2025-10-15)
- 解读:河北做好2025年城乡住民根本医疗保证无关任务 (2025-10-15)
- 江西:进一步推动集采药品“三进”任务走深走实 (2025-10-15)
- 广西展开医疗服务价钱规范管理(第六批)的关照 (2025-10-15)
- “传统中药+益生菌”要结合起来吃?Phytomedicine:六味地黄丸协同动物双歧杆菌改善围绝经期动脉粥样硬化新机制 (2025-10-15)
- Nature子刊:深圳湾实验室甘文标团队揭示大脑如何保护学会的技能不丢失 (2025-10-15)
- 碧迪医疗首款港澳药械通器械获批,中国恶性胸腔积液治疗实现全球同步 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















