MC:郑州大学团队发现胃癌免疫治疗新靶点 首次揭示其在塑造胃癌免疫微环境中的作用 |
 |
来源:奇点蛋糕2022-05-06 09336038
胃癌是一种常见的消化道恶性肿瘤,在我国发病率居癌症的第三位[1]。FDA批准使用PD-1/PD-L1抑制剂治疗胃癌,但客观缓解率仅为22%左右[2]。因此,我们需要进一步研究胃癌对免疫治疗耐药的机制。
它是一种常见的恶性肿瘤,在我国癌症发病率中排名第三[1]。PD-1/PD-L1抑制剂被批准用于治疗胃癌,但其客观缓解率仅为22%左右[2]。因此,我们需要对胃癌耐药治疗的机制进行更深入的研究,以发展靶向治疗。
LSD1是第一个被鉴定的组蛋白去甲基化酶,它可以去除组蛋白H3K4中的甲基,并调节许多基因的转录[3,4]。LSD1还可作为癌基因促进各种肿瘤的发生发展[5,6]。先前的研究表明,LSD1可以通过塑造抑制性微环境(TME)促进胶质瘤和三阴性的发展[7,8]。抑制LSD1可以增强抗肿瘤免疫反应,提高PD-1/PD-L1抑制剂的疗效[9,10]。
另有研究表明,LSD1在胃癌中的表达显著上调,LSD1可促进胃癌细胞的增殖和转移。抑制LSD1可以抑制胃癌细胞的增殖和转移[11]。然而,LSD1是否在胃癌微环境中发挥免疫调节作用尚不清楚。
最近,郑州大学刘宏民教授和郑一超副教授领导的研究小组在《分子癌症》杂志上发表了研究成果[12]。他们发现,LSD1在胃癌细胞中的高表达可以促进PD-L1在外泌体中的积累,从而抑制T细胞免疫反应。敲除胃癌细胞中的LSD1可以显著增强抗肿瘤免疫反应,抑制肿瘤生长。
研究结果首次揭示了LSD1在塑造胃癌免疫微环境中的作用,提示LSD1可能成为胃癌治疗的新靶点。

报纸首页截图
研究小组通过分析公共数据库中的测序数据发现,LSD1的表达水平与胃癌中的CD8 T细胞浸润呈负相关。
为了确定LSD1在肿瘤细胞中的表达是否影响T细胞的抗肿瘤免疫反应,研究小组将敲除LSD1的肿瘤细胞系或WT肿瘤细胞系,接种到WT小鼠(615小鼠)或T细胞缺陷裸鼠的皮肤中,观察肿瘤生长趋势。他们发现,LSD1敲除的肿瘤细胞在WT小鼠中的生长明显受到抑制,但在裸鼠中没有。这些结果表明,LSD1可能通过抑制T细胞反应来促进肿瘤生长。
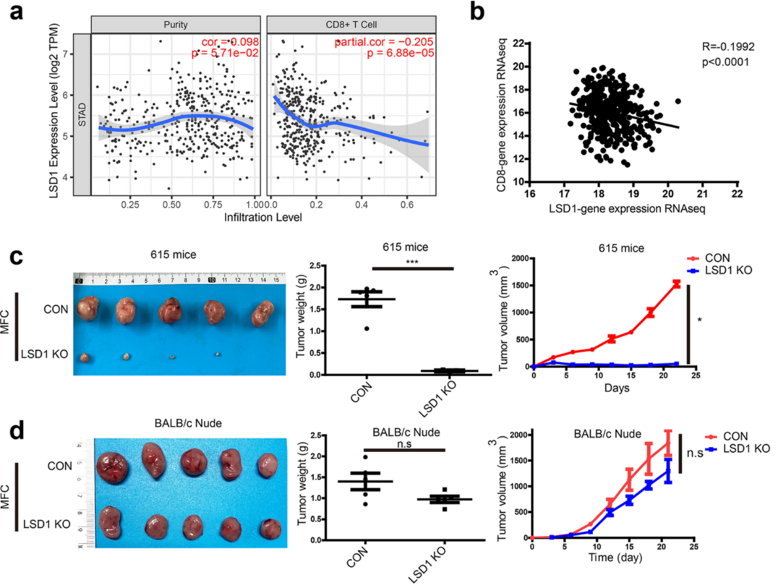
敲除肿瘤细胞中的LSD1以T细胞依赖的方式抑制肿瘤生长。
由于抑制LSD1可以增强抗肿瘤免疫反应,增强PD-1/PD-L1抑制剂在乳腺癌和黑色素瘤中的抗肿瘤疗效[9,10],研究小组推测LSD1可能通过PD-L1抑制T细胞的活化。
为了验证这一猜想,他们用免疫组织化学染色了胃癌患者的临床标本。结果显示,LSD1在癌组织中的表达明显高于癌旁组织,PD-L1与LSD1的表达呈正相关,而CD8 T细胞的数量与LSD1的表达水平呈负相关。这些结果表明,LSD1和PD-L1之间可能存在调节关系。
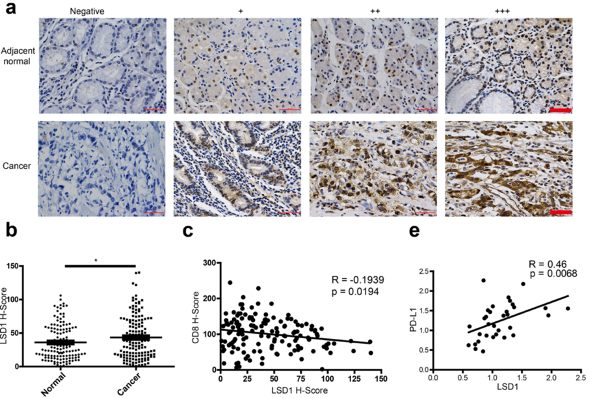
胃癌组织中LSD1的表达与PD-L1呈正相关。
为了研究LSD1是否可以调节PD-L1,研究小组使用了LSD1抑制剂GSK2879552来抑制LSD1的功能,或者使用sgRNA来敲低肿瘤细胞系中LSD1的表达。发现PD-L1的mRNA水平在抑制/敲除LSD1后显著降低。
然而,当通过Western blot检测PD-L1的蛋白水平时,发现LSD1的抑制/敲除不影响细胞膜上的PD-L1水平,但显著降低了肿瘤细胞外泌体上的PD-L1水平。这些数据表明,LSD1可以调节PD-L1的表达,并通过外泌体促进PD-L1的分泌。
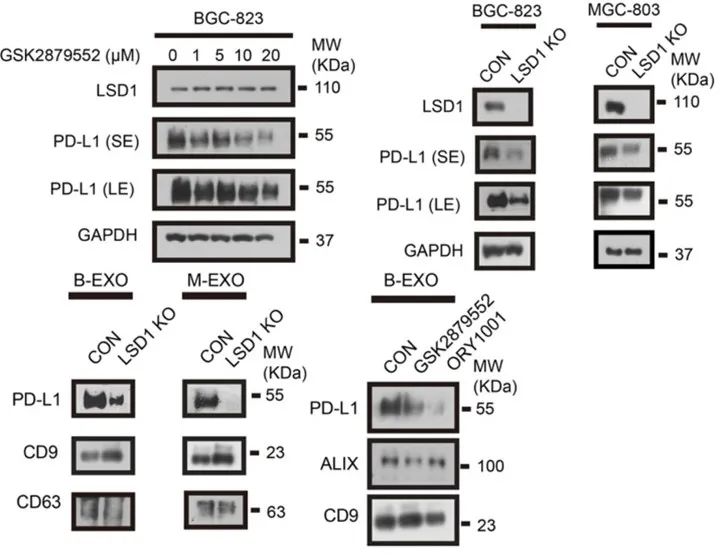
LSD1促进PD-L1通过外泌体分泌到细胞中。
那么,PD-L1,一个外星人
研究小组将来自胃癌细胞系BGC-823的外泌体(B-EXO)或来自LSD1-KO BGC-823的外泌体(B KO-EXO)与T细胞共孵育。电镜成像显示B-EXO能与T细胞表面结合,但B-KO-EXO的结合能力明显下降。
他们还发现,B-EXO可以显著抑制T细胞的活化,而这种抑制作用可以被PD-L1抗体削弱。然而,与B KO-EXO孵育的T细胞的活化水平没有显著变化。这些数据表明,LSD1促进外泌体中PD-L1水平的增加,并以PD-L1依赖的方式抑制T细胞的活化。
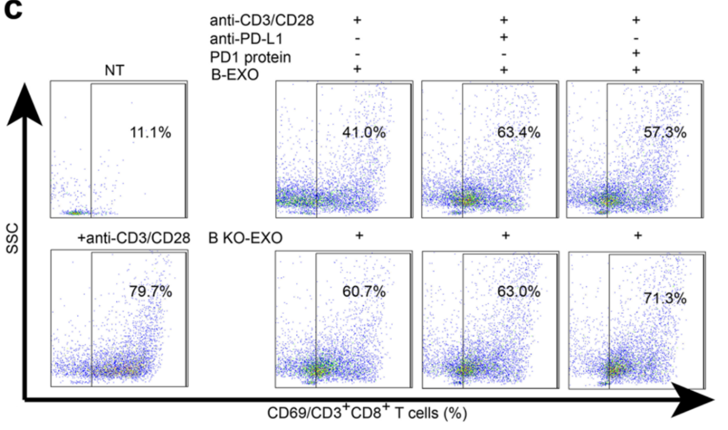
LSD1促进肿瘤细胞的外来体以PD-L1依赖的方式抑制T细胞活性。
我们都知道,外来体是肿瘤微环境中细胞间通讯的关键参与者。虽然来源于胃癌细胞的外泌体可以直接抑制T细胞活化,但外泌体是否可以将PD-L1传递给其他癌细胞以及LSD1在这一过程中的作用尚不清楚。
为了探索这个问题,研究小组将荧光标记的B-EXO和B-EXO与PD-L1低表达的胃癌细胞MGC-803共孵育。结果表明,-EXO能将PD-L1转移到肿瘤细胞膜上。当活化的CD8 T细胞与B-exo处理的MCG-803共培养时,其表面活化标记CD69的表达显著下调,而与B-exo处理的MCG-803相比。这表明外泌体中的PD-L1可以转运到其他癌细胞,从而诱导肿瘤免疫逃逸,而LSD1的缺失则削弱了这种作用。
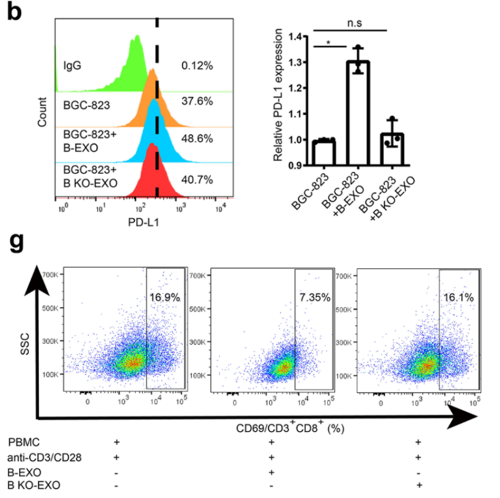
LSD1促进PD-L1以外泌体依赖的方式转移到其他肿瘤细胞表面。
上述体外实验证实,LSD1可增强胃癌细胞来源的外来体抑制T细胞免疫反应的能力。为了在体内验证上述发现,研究小组构建了皮下肿瘤小鼠模型。他们发现,在肿瘤细胞中敲除LSD1后,肿瘤生长明显放缓。在肿瘤小鼠体内注射WT肿瘤细胞的外来体明显加速肿瘤的生长,同时注射PD-1重组蛋白可以缓解这种效应。
对肿瘤浸润的免疫细胞的分析表明,LSD1敲除后,肿瘤浸润的CD8 T细胞数量显著增加,T细胞分泌细胞因子的能力也显著增加。这些结果表明,LSD1在体内可以加速肿瘤的生长,这种促瘤作用部分依赖于促进肿瘤细胞分泌PD-L1阳性外来体和抑制T细胞免疫反应。
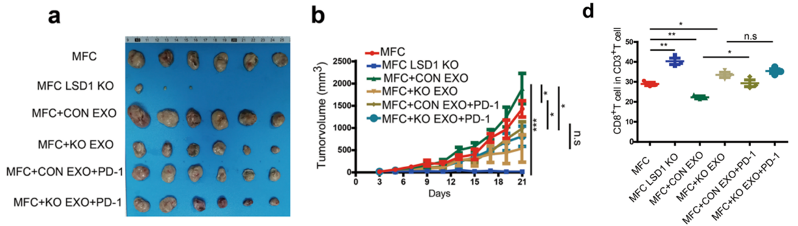
LSD1可以增强胃癌细胞外来体抑制T细胞免疫反应的能力。
总的来说,本研究表明LSD1可以通过增加外泌体中的PD-L1来抑制T细胞的抗肿瘤功能。更重要的是,以外来体为载体,LSD1肿瘤细胞可以将PD-L1转移到其他肿瘤细胞,从而促进肿瘤的免疫逃逸。
这些发现表明,LSD1可能是治疗胃癌的新靶点,有望通过进一步的研究探索LSD1抑制剂与PD-1/PD-L1抑制剂联合应用是否能提高免疫治疗效果。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- Science:肾脏应激源引起的线粒体DNA突变可能有助于预测未来的器官衰退 (2025-10-25)
- Nature Genetics:告别拷贝数“估算”时代——ctyper如何利用泛基因组破译重复基因的序列天书? (2025-10-25)
- 《神经元》:科学家首次发现,TREM2-T96K突变与女性患阿尔茨海默病风险增加相关! (2025-10-25)
- 2025年药物警戒任务会议召开 (2025-10-24)
- Nat Commun:皮肤细胞“变身”卵子?科学家开创不孕治疗新路径 (2025-10-24)
- 3D微纳机器人研究获进展 (2025-10-24)
- Science:1+1>2的智慧!蚂蚁的“建筑免疫”如何与个体隔离行为协同增强群体抗性 (2025-10-24)
- 西藏社保系统完成跨越式倒退 织密高原“平易近生保证网” (2025-10-23)
- 重磅!杭州医保新政宣布!来岁1月1日起施行 (2025-10-23)
- “搞笑诺贝尔奖”研究,再登Cell子刊:人类也可以通过肛门呼吸,关键时刻能救命,已开展人体临床试验 (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















