汽车 |
 |
来源:100医疗网原创2022-08-30 11:29
CAR-T(嵌合抗原受体T细胞免疫疗法),即嵌合抗原受体T细胞免疫疗法。
嵌合抗原受体T细胞免疫疗法(T细胞免疫疗法),即嵌合抗原受体T细胞疗法。这种疗法是一种新的细胞疗法,已经出现很多年了,只是近几年才得到改进并应用于临床。在治疗急性非霍奇金病方面疗效显著,被认为是最有前途的肿瘤治疗方法之一。就像所有的技术一样,CAR-T技术经历了漫长的进化过程,也正是在这一系列的进化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键是识别靶细胞的人工受体,称为嵌合抗原受体(CAR),经过基因修饰后,患者的T细胞可以表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程从患者体内提取了一些T细胞,然后在实验室中对其进行基因改造,并引入编码这种CAR的基因,使这些T细胞能够表达这种新的受体。这些转基因T细胞在实验室中增殖,然后被输回病人体内。这些T细胞利用其表达的CAR受体与靶细胞表面的分子结合,这种结合触发了内部信号的产生,然后这种信号如此强烈地激活这些T细胞,以至于它们迅速摧毁靶细胞。
近年来,CAR-T免疫疗法除了用于治疗急性白血病和非霍奇金淋巴瘤外,经过改进,还用于治疗实体瘤、自身免疫性疾病、HIV和心脏疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞治疗的最新进展,边肖为读者做了盘点。
1.Nat Biotechnol:使用改进的CRISPR-Cas9基因编辑系统,高效地将长DNA序列引入细胞基因组中的精确位点。
doi :10.1038/s 41587-022-01418-8
CRISPR-Cas9基因编辑系统的新变体使得对大量细胞进行遗传修饰以用于治疗应用变得更加容易。这种方法由Gladstone Institute和加州大学旧金山分校开发,使科学家能够以非常高的效率将超长DNA序列引入细胞基因组的精确位置,而不需要传统上用于将DNA携带到细胞中的病毒传递系统。相关研究成果于2022年8月25日在线发表在《自然生物技术》杂志上,题目是“使用杂交SS DNA修复模板和小分子鸡尾酒在原代细胞中进行高产基因组工程”。
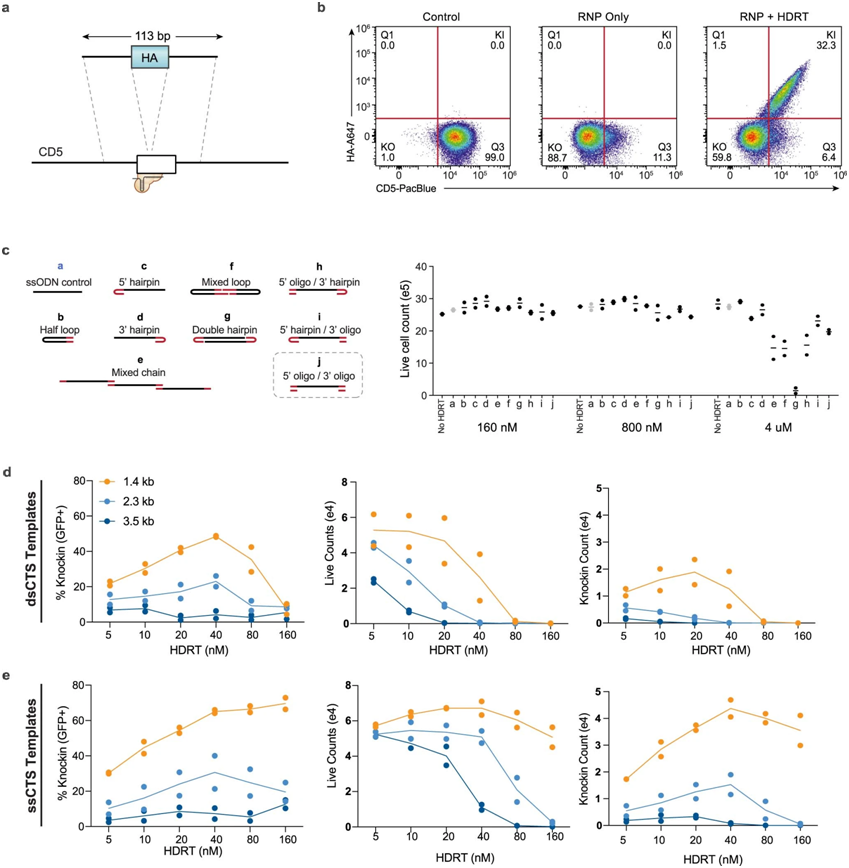
CTS(Cas9靶序列)模板设计对比,图片来自Nature Biotechnology,2022,doi :10.1038/s 41587-022-01418-8。
DNA可以以单链或双链的形式存在,Cas9会附着在双链DNA上。这些作者很快发现高水平的双链DNA模板对细胞有毒性,所以这种方法只能用于低水平的模板DNA,会导致编辑效率低下。他们知道单链DNA对细胞的毒性较小,即使在相对较高的浓度下。因此,在这篇新论文中,他们描述了一种将改进的Cas9酶附着到单链DNA模板上的方法,只需在两端添加一个短的悬空双链DNA。与传统的双链DNA模板相比,单链DNA模板可以将基因编辑的效率提高一倍以上。单链DNA分子的双链末端允许人们使用Cas9来增强非病毒载体在细胞中的传递。
在这项新的研究中,这些作者使用新的DNA模板生成了超过10亿个针对多发性骨髓瘤的CAR-T细胞。CAR-T细胞是经过基因改造的T细胞,可以有效对抗特定细胞或癌症。利用Cas9引导的新单链模板,大约一半的T细胞获得了新的基因,并被转化为CAR-T细胞。
该论文的共同作者、加州大学旧金山分校血液和肿瘤学系医学助理教授贾斯汀埃克姆(Justin Eyquem)博士说,我们知道将DNA模板靶向基因组中称为TRAC (T细胞受体常数)位点的特定位点将提高CAR-T细胞的抗肿瘤功效。这种新的非病毒方法使我们能够更有效地实现这一目标,这将加快下一代CAR-T细胞疗法的发展。
2.自然:大进步!抑制RASA2基因可使T细胞在肿瘤微环境中持续杀伤癌细胞,有望治疗一系列实体肿瘤和液体肿瘤。
doi :10.1038/s 41586-022-05126-w
用于免疫治疗的t细胞会因为对抗癌细胞的任务而变得功能衰竭,或者进入肿瘤后失去活性。在一项新的研究中,通过基于CRISPR编辑这些细胞的基因组,来自加州大学旧金山分校、格拉斯顿研究所和以色列特拉维夫大学的研究人员使这些治疗性T细胞更具活力。这一发现可能有助于克服限制这种有前途的治疗方法在抑制实体肿瘤和液体肿瘤方面取得成功的主要因素。相关研究成果发表在2022年8月24日的《自然》杂志上,论文标题为
为 RASA2 ablation in T cells boosts antigen sensitivity and long-term function 。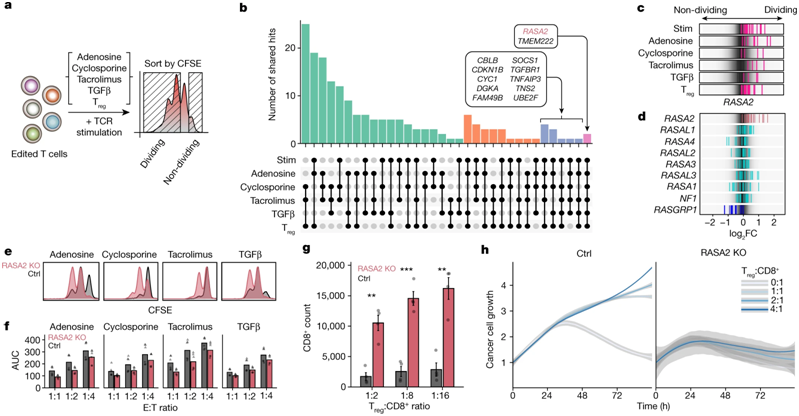
在原代人T细胞中进行的多种全基因组CRISPR筛选发现RASA2是一种抵抗免疫抑制环境的调节因子。图片来自Nature, 2022, doi:10.1038/s41586-022-05126-w。
这些作者构建出敲除RASA2基因的T细胞。他们然后让这些T细胞接受各种 应激测试 ,让它们反复暴露在癌细胞以及肿瘤微环境模型中。他们将这些RASA2基因敲除的T细胞的表现与仍然含有正常RASA2基因的原始治疗性T细胞的表现进行了比较。在原始的T细胞失去抗癌能力很久之后,RASA2基因敲除的T细胞仍然非常不知疲倦。
这些作者在对不同类型的阻断RASA2的工程化T细胞进行了测试以及对来自许多不同人类供者的T细胞以及液体癌症和实体瘤模型进行了测试,他们获得的结果是一致的。Carnevale说, 这些敲除RASA2基因的T细胞可以持续杀死癌细胞。我们似乎找到了T细胞功能的抑制因子,当我们去除它时,我们就能释放出这些治疗性T细胞的潜力。
3.
doi:10.1126/scitranslmed.abn1128
美国威斯康星大学麦迪逊分校药学院药物科学部助理教授Quanyin Hu解释说, 胶质母细胞瘤的一个特点是,肿瘤细胞非常具有侵略性,它们会渗透到周围的组织中。所以外科医生不能清楚地感觉到肿瘤和正常组织之间的界限,而且你不能尽可能多地切除,因为大脑中的所有组织都非常重要---你当然不想切除太多。因此,这种肿瘤会再次复发,而这大大降低了治疗后的存活率。
但是Hu实验室已开发出一种强大的免疫增强性术后治疗方法,可能改变胶质母细胞瘤患者的胜算。在一项新的研究中,Hu和他的合作者发表了他们关于该疗法在人类胶质母细胞瘤小鼠模型中的应用。相关研究结果发表在2022年8月3日的Science Translational Medicine期刊上,论文标题为 Intracavity generation of glioma stem cell specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy 。

Hu实验室开发了一种水凝胶,它可以被注射到切除肿瘤后留下的脑腔中。Hu指出,这种水凝胶给送方法效果很好,因为它完全填满了脑腔,缓慢地将它携带的纳米颗粒释放到周围组织中,并促进杀癌免疫反应。
这种水凝胶含有携带着编码嵌合抗原受体(CAR)的基因的纳米颗粒,这些纳米颗粒旨在进入某些类型的免疫细胞---称为巨噬细胞---并使它们表达可以靶向胶质瘤的CAR,由此产生的巨噬细胞称为CAR巨噬细胞(CAR macrophage, CAR-M)。这些免疫细胞通常会清理体内的传染性入侵者,但在肿瘤环境中,它们可能会转变为抑制免疫系统和促进癌症生长的形式。由于手术造成的炎症,这些叛变的巨噬细胞会涌向手术部位,可能会助长癌症复发。Hu说, 我们想利用这些巨噬细胞,把它们从敌人变成盟友。
为了做到这一点,这些纳米颗粒进入这些巨噬细胞并使它们表达的CAR靶向一种叫做CD133的糖蛋白,这是胶质瘤干细胞的一种标志物。Hu及其研究团队还添加了一种CD47抗体,它能阻止 不要吃我 的信号,从而促进CAR-M细胞识别癌细胞。针对小鼠模型的临床前结果显示这种水凝胶治疗成功地产生了胶质瘤干细胞特异性的CAR-M细胞 ---本质上就是在现场对巨噬细胞进行重编程,使之靶向并杀死任何残留的胶质瘤干细胞。
4.
doi:10.1182/blood.2021015020
在一项新的研究中,来自美国圣犹大研究医院的研究人员改进了嵌合抗原受体(CAR)T细胞(CAR-T)疗法。他们新的简化方法选择了一种有利的T细胞类型,并在实验室中显示出对抗复发的T细胞急性淋巴细胞白血病(T-ALL)的前景。相关研究结果于2022年8月1日在线发表在Blood期刊上,论文标题为 Engineering Naturally Occurring CD7 Negative T Cells for the Immunotherapy of Hematological Malignancies 。
几种治疗复发性T-ALL的CAR-T细胞疗法靶向抗原CD7。这种抗原存在于许多T-ALL癌细胞表面上,就像这些癌细胞挥舞着同样的旗帜一样。然而,有一个问题。论文共同第一作者、圣犹大儿童研究医院的Abdullah Freiwan说, 大多数正常T细胞也表达CD7,而且因为这些CAR-T细胞战士完全听从命令。它们会杀死任何携带这种特定标志物的细胞,即使这意味着互相残杀。

图片来自Blood, 2022, doi:10.1182/blood.2021015020。
这些作者专注于一小群天然不表达CD7的T细胞。他们产生了一种选择和扩大这些细胞的方法,然后将它们制成CAR-T细胞。在实验室研究中,这些不表达CD7的CAR-T细胞表现非常好,有效地清除了肿瘤。在小鼠模型的癌症复发实验(再挑战)中,这些细胞还提供了长期保护。
5.
doi:10.1126/sciimmunol.abj9123
在与癌症斗争的过程中,T细胞会变得功能衰竭,不再能够正常运作。在功能衰竭的早期阶段有时可以用免疫治疗药物加以逆转,但一旦T细胞变得过于衰竭,人们之前认为这种状态是不可逆转的。然而,在一项新的研究中,来自美国匹兹堡大学的研究人员指出即使是最为衰竭的T细胞也能恢复活力。相关研究结果发表在2022年8月5日的Science Immunology期刊上,论文标题为 Tumor microenvironmental signals reshape chromatin landscapes to limit the functional potential of exhausted T cells 。

在这项新的研究中,这些作者剖析了T细胞在黑色素瘤小鼠模型中从早期到晚期衰竭的分子特征。他们出乎意料地发现,即使是最末期衰竭的T细胞也保留了一些再次发挥作用的能力,并确定了克服衰竭的方法,从而为癌症免疫疗法开辟了潜在的新途径。
为了完全激活,T细胞有两个开关:T细胞受体和一种共刺激信号。这些作者发现,末期衰竭的T细胞没有足够的共刺激信号。当他们使用一种结合称为4-1BB的共刺激受体的抗体时,基因表达增加,从而增强了T细胞的活性。另一个关键发现是,在肿瘤微环境中常见的低氧或缺氧促成了末期衰竭T细胞的基因表达受损。当这些作者对T细胞进行重编程,使它们对缺氧有抵抗力时,它们就会分化成一种更有功能的状态。
这些作者说,利用末期衰竭的T细胞进行免疫治疗的潜在新方法包括靶向缺氧或共刺激途径的药物或设计对抗功能衰竭的CAR-T细胞。
6.
doi:10.1016/j.celrep.2022.111128
在一项新的研究中,来自美国普渡大学的研究人员对传统方法进行了改进,生产出现成的具有强大抗肿瘤活性的人类免疫细胞。相关研究结果发表在2022年7月19日的Cell Reports期刊上,论文标题为 Engineering chimeric antigen receptor neutrophils from human pluripotent stem cells for targeted cancer immunotherapy 。
论文共同通讯作者、普渡大学戴维森化学工程学院助理教授Xiaoping Bao说,经过基因改造后表达嵌合抗原受体(CAR)的中性粒细胞(以下称CAR中性粒细胞)以及可移植的造血干细胞是治疗血液疾病和癌症的有效方法。中性粒细胞是最丰富的白细胞类型,能有效地穿过生理屏障渗透到实体瘤中。造血干细胞将在一生中补充所有的血细胞谱系,包括中性粒细胞。
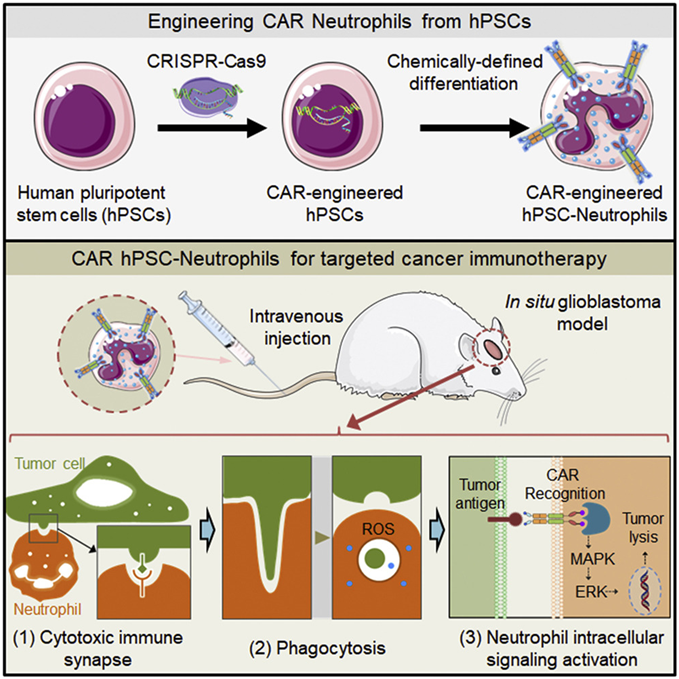
图片来自Cell Reports, 2022, doi:10.1016/j.celrep.2022.111128。
Bao开发了一种提交了专利申请的方法:利用人类多能性干细胞(hPSC)---即可以自我更新并能分化为任何类型人细胞的干细胞---大量产生CAR中性粒细胞。经过基因改造后,CAR可在hPSC表面上表达,然后通过一种新的、化学定义的方法将它们转化为功能性的CAR中性粒细胞。
7.
doi:10.3324/haematol.2021.279301
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员开发出一种来提高CD123特异性的engager(ENG)T细胞杀死急性骨髓性白血病(AML)的能力。该方法在针对难以治疗的复发疾病的临床前模型中显示出前景。相关研究结果于2022年7月28日在线发表在Haematologica期刊上,论文标题为 Improving the anti-acute myeloid leukemia activity of CD123-specific Engager T cells by MyD88 and CD40 costimulation 。
尽管小儿白血病治疗取得了进展,但复发性AML的临床结果仍然不佳。科学家们正在探索多种潜在的治疗方法。一种方法是使用ENG T细胞。这些细胞是经过基因改造的免疫细胞,可以分泌使T细胞和癌细胞结合在一起的抗体,促进对肿瘤的杀伤。在这种新的研究中,这些作者开发出一种改进ENG T细胞的方法,使该疗法更加高效和有效。他们在ENG构造体中加入了一个由一种称为二聚化学诱导剂(chemical inducer of dimerization)的小分子激活药物控制的共刺激系统,该系统由共刺激分子MyD88和/或CD40组成。临床前研究结果显示,该方法提高了ENG T细胞的抗AML活性。
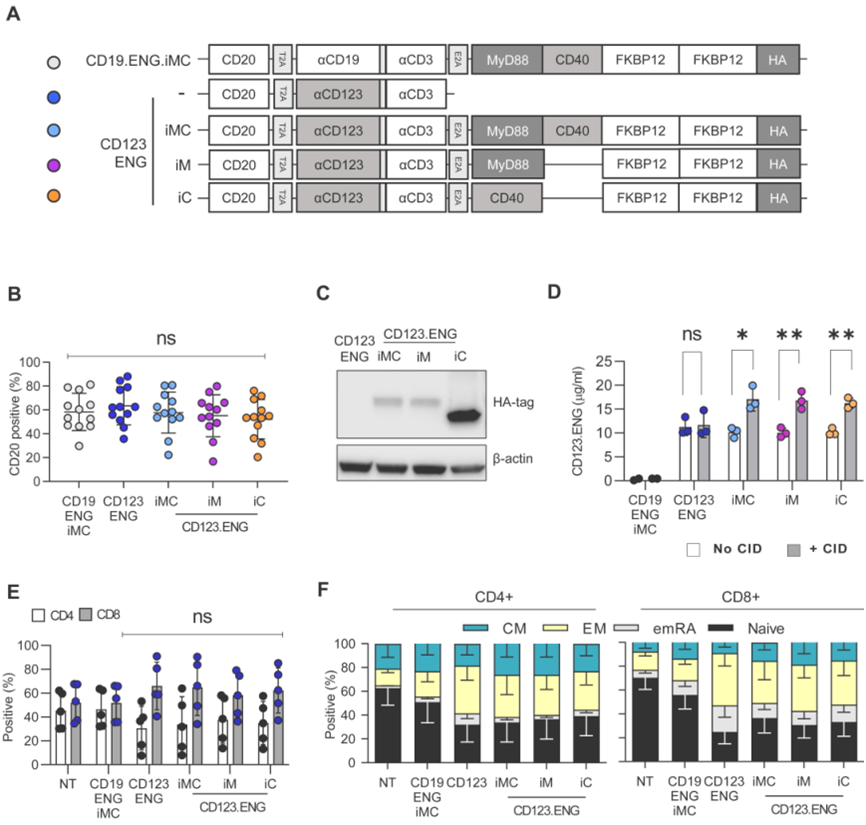
图片来自Haematologica, 2022, doi:10.3324/haematol.2021.279301。
论文通讯作者、圣犹大儿童研究医院骨髓移植与细胞治疗系Paulina Velasquez博士说, 我们基本上是让T细胞表达我们可以控制的共刺激分子。ENG T细胞分泌一种蛋白,使这些T细胞能够杀死白血病。在这种情况下,当它们也表达我们添加的共刺激分子时,我们让这些细胞获得额外的效应功能。
8.
doi:10.1016/j.stem.2022.06.014
在CAR-T细胞免疫疗法中,来自患者自身血液中的T细胞能被工程化改造为携带嵌合抗原受体(CAR),从而增强T细胞攻击和杀灭肿瘤细胞的能力,当CAR-T细胞疗法能作为治疗特定白血病和淋巴瘤的强大手段时,很多病人仍然无法使用这种有效的疗法。近日,一篇发表在国际杂志Cell Stem Cell上题为 EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity 的研究报告中,来自波士顿儿童医院等机构的科学家们通过研究或有望让CAR-T细胞疗法能够更加广泛地使用。
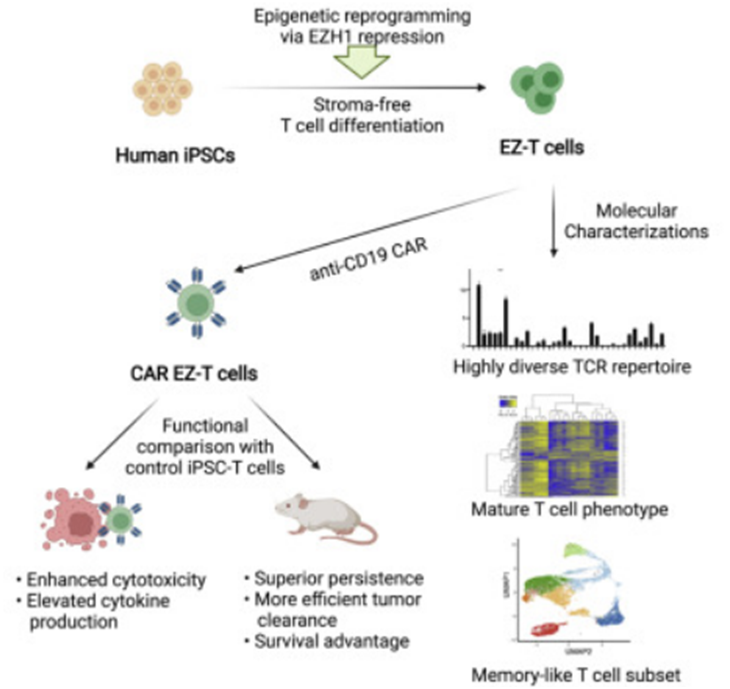
科学家有望制造出更好的现成可用的CAR-T细胞来用于癌症免疫疗法。图片来源:Cell Stem Cell (2022). DOI: 10.1016/j.stem.2022.06.014。
本文研究中,研究人员就利用诱导多能干细胞(iPSC)开发了一种新方法来制造通用型的CAR-T细胞,其或能大规模生产并用于多名患者的治疗。在研究涉及血液发育的表观遗传学因素时,研究人员锁定了一种名为EZH1的酶类,其能限制成熟淋巴细胞的分化,而抑制EZH1则能促使iPS细胞制造成熟的T细胞,同时研究人员还开发了一种新型培养系统,其能避免与鼠源性细胞共培养,因为后者的培养较为困难,而且产生的T细胞也并不够成熟。
当iPS细胞衍生的T细胞被进一步转化为CAR-T细胞时,其所显示出的抗肿瘤活性就与目前用于临床疗法的方法所产生的CAR-T细胞的抗肿瘤活性相当,当与此前iPS细胞方法所制造的T细胞相比,这些新细胞在实验室中杀灭癌细胞和清除活体小鼠癌细胞的能力都有所增强。研究者Daley表示,经过多年的研究,如今我们发现iPS细胞最终或能帮助开发用于治疗诸如癌症等多种人类疾病的新型疗法。(100yiyao.com)
相关100医药网新闻:
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 今年第5篇Cell、Nature、Science正刊!姜长涛团队最新Cell论文,利用AI工具,挖掘出超60万种胆汁酸代谢酶 (2025-08-09)
- iScience:惊!夜间喝咖啡竟会增加冲动行为,尤其是女性 (2025-08-08)
- 事关脑机接口家当立异倒退 七部分宣布重磅文件 (2025-08-08)
- PD-(L)1/VEGF之后,双抗BD的新王牌藏在哪? (2025-08-08)
- 辉瑞2025H1:ADC产品销售收入15亿美元,还有130亿美元BD弹药 (2025-08-08)
- Nature Methods:从“我猜”到“我证”的进化——当AI学会主动查资料,我们离“可信科研伙伴”更近一步 (2025-08-08)
- Science:解码“冬眠超能力”!下丘脑中的远古基因开关,或将改写人类代谢的未来 (2025-08-08)
- 专家报告派特灵新进展 2025妇产科医师大会聚焦中医药创新 (2025-08-07)
- Nature:免疫系统不认“脸”,只认“伤”?“细胞破损”才是拉响过敏警报的通用语言 (2025-08-07)
- 陆军军医大学最新论文登上Cell头条 (2025-08-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















