FDA解除沙瑞普塔公司新一代反义RNA疗法的临床暂停 |
 |
来源:医学魔方2022-09-08 16336032
今年6月,FDA停止了该诊所,因为一名B期患者出现了严重的低镁血症不良事件。
最近,FDA解除了用于杜氏肌营养不良症的SRP-5051 (Vesleteplersen)的II期临床暂停。在与FDA协商后,Sarepta Therapeutics调整了临床试验计划,包括扩大对尿液生物标志物的监测。

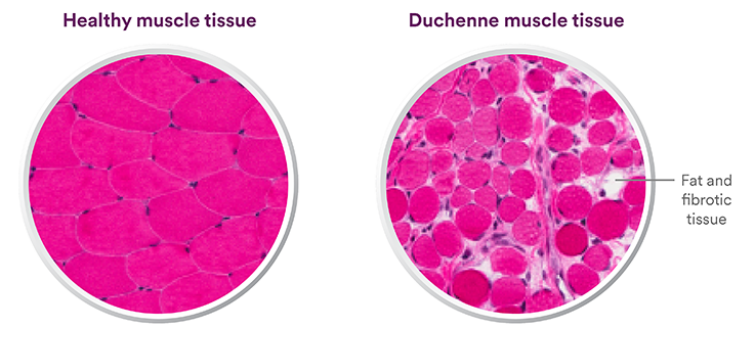
杜兴肌营养不良症(DMD)是一种罕见的疾病,具有致命的遗传性神经肌肉萎缩。它是由编码肌营养不良蛋白的基因突变引起的。最常见的形式是缺失一个或多个外显子(基因的一部分)。正常情况下,dystrophin表达在细胞膜上,与其他蛋白质相互作用,发挥保护作用。而DMD患者很少或不表达这种蛋白,导致肌肉细胞过度损伤和炎症,最终肌肉被疤痕和脂肪组织取代。
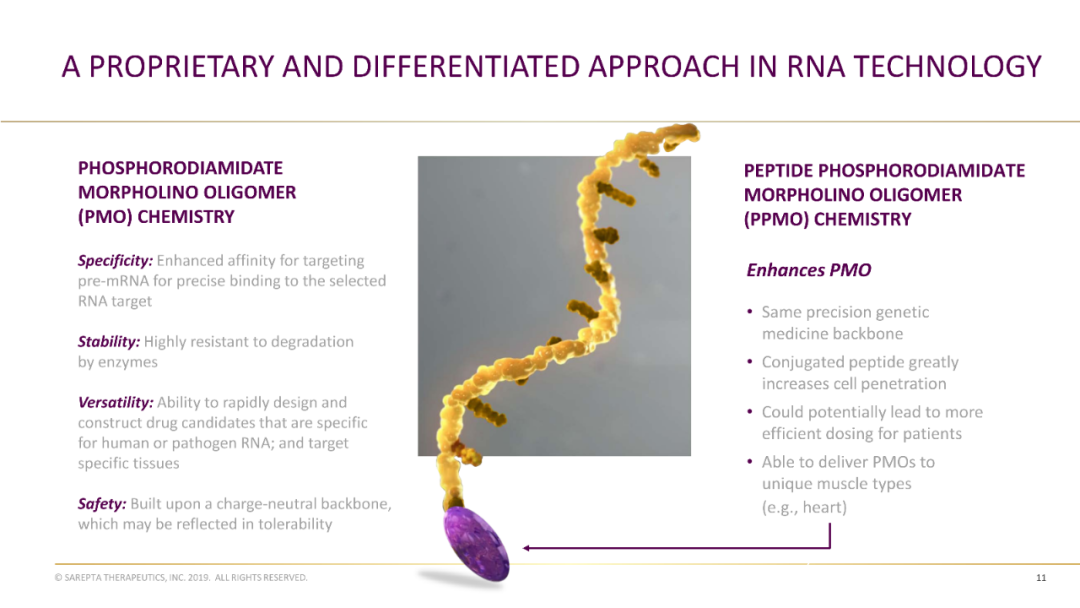
SRP-5051采用公司专有的肽偶联磷酸二酰胺吗啉低聚物(PPMO)化学修饰和外显子跳跃技术。SRP-5051通过与前体mRNA上的外显子51结合,跳过了基因突变片段,实现了蛋白质结构较短但功能正常的dystrophin的产生。
基于PMO(磷酸二甲酯吗啉低聚物)技术开发了沙瑞普他疗法的外显子51。2016年被FDA批准上市,成为全球首个治疗DMD的药物。在PMO骨架的基础上,新一代PPMO连接了一种穿膜肽,可以增强组织渗透。因此,SRP-5051的疗效有望更好,且有减少患者用药次数的潜力。
MOMENTUM是一项II期随机、开放标签研究,分为A、B两个阶段,分别为剂量递增和剂量扩大。
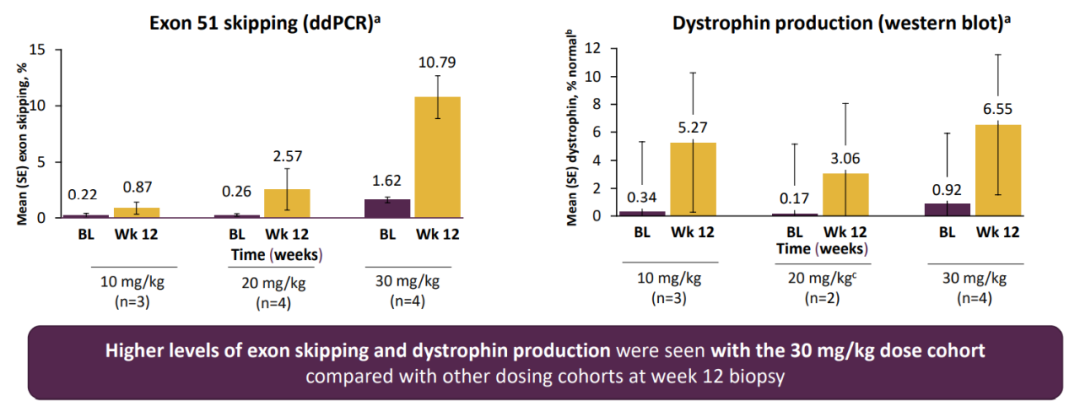
2021年,该公司公布了a阶段的结果,与每周一次的外显子51治疗相比,每月一次的SRP-5051(30mg/kg)治疗使外显子51跳跃的频率增加了18倍,dystrophin的产生增加了8倍。
今年6月,FDA停止了该诊所,因为一名B期患者出现了严重的低镁血症不良事件。在接受补充治疗后,患者血清中的镁离子水平恢复正常。在之前的A期试验中,一些患者出现了可逆性低镁血症。
值得一提的是,Sarepta Therapeutics于2019年与罗氏达成合作,共同研发另一款DMD药物SRP-9001,交易总金额为28.5亿美元。
我们感谢FDA的密切合作机会,使临床问题得以迅速解决。我们将尽快实施协议中的变更,以恢复美国的患者管理。Sarepta Therapeutics的执行副总裁兼首席科学官Louise Rodino-Klapac博士说:我们的监测计划旨在避免低镁血症的风险。MOMENTUM将继续招募美国以外的患者,我们仍有望在年底前完成注册。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- 今年第5篇Cell、Nature、Science正刊!姜长涛团队最新Cell论文,利用AI工具,挖掘出超60万种胆汁酸代谢酶 (2025-08-09)
- iScience:惊!夜间喝咖啡竟会增加冲动行为,尤其是女性 (2025-08-08)
- 事关脑机接口家当立异倒退 七部分宣布重磅文件 (2025-08-08)
- PD-(L)1/VEGF之后,双抗BD的新王牌藏在哪? (2025-08-08)
- 辉瑞2025H1:ADC产品销售收入15亿美元,还有130亿美元BD弹药 (2025-08-08)
- Nature Methods:从“我猜”到“我证”的进化——当AI学会主动查资料,我们离“可信科研伙伴”更近一步 (2025-08-08)
- Science:解码“冬眠超能力”!下丘脑中的远古基因开关,或将改写人类代谢的未来 (2025-08-08)
- 专家报告派特灵新进展 2025妇产科医师大会聚焦中医药创新 (2025-08-07)
- Nature:免疫系统不认“脸”,只认“伤”?“细胞破损”才是拉响过敏警报的通用语言 (2025-08-07)
- 陆军军医大学最新论文登上Cell头条 (2025-08-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















