JITC:科学家筛选靶向帕金森病 |
 |
来源:奇点蛋糕2022-10-18 17:09
众所周知,口服小分子抑制剂生物利用度高,半衰期短,在肿瘤病灶内扩散速度较大[4]。因此,近年来,越来越多的科学家开始研发针对PD-1/PD-L1的小分子抑制剂。
基于检查点抑制剂的免疫治疗已成为抑制多种肿瘤进展的有效手段之一[1,2]。
但目前仍有大量患者对已批准临床使用的免疫检查点抑制剂(多为单克隆抗体药物)无反应[3]。
另外,单克隆抗体需要静脉注射,生产成本高,在一定程度上限制了其临床应用。
众所周知,口服小分子抑制剂生物利用度高,半衰期短,在肿瘤病灶内扩散速度较大[4]。因此,近年来,越来越多的科学家开始研发针对PD-1/PD-L1的小分子抑制剂。
众所周知,到目前为止,临床上还没有批准有效的PD-1/PD-L1小分子抑制剂。
近日,由葡萄牙里斯本大学的Helena F. Florindo和Rita C. Guedes以及以色列特拉维夫大学的Ronit Satchi-Fainaro领导的研究团队在著名期刊《癌症免疫疗法杂志》(JiTC)上发表了他们关于筛选新型PD-L1小分子抑制剂的重要研究成果[5]。
在这项研究中,研究人员通过计算机辅助药物筛选技术发现了一种新的小分子抑制剂,可以调节PD-1和PD-L1之间的相互作用。他们从体外细胞实验、体外T细胞培养实验和体内抗肿瘤实验三个方面评估了该抑制剂调节PD-1/PD-L1相互作用和增强T细胞功能的能力。
结果表明,其筛选的PD-1/PD-L1信号通路小分子抑制剂能有效抑制PD-1/PD-L1信号通路,促进小鼠细胞毒性T细胞(CTL)广泛浸润肿瘤微环境,且无明显全身毒性。

论文的第一页
事不宜迟,我们来看看研究人员是如何进行这项研究的。
首先,为了寻找新的PD-1/PD-L1小分子抑制剂,研究人员基于人PD-L1的晶体结构进行了虚拟筛选。他们从几个合成化合物库(国家癌症研究所,烯胺,Specs,Mu)筛选了近90万个化合物。Ta.Lig Chemoteca,MMV和研究团队自己的合成化合物库)通过分子对接。
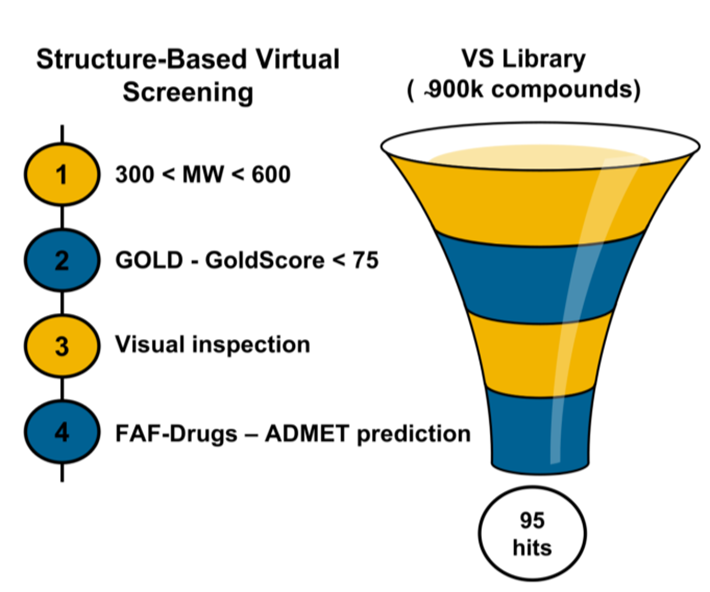
基于人钯L1晶体结构的虚拟筛选
随后,研究人员对对接排名最高的化合物进行了更详细的对接分析,以更高的精度预测了受体结合口袋中相应化合物的结合姿态和相互作用。最后,他们根据五倍放大法则筛选出最终的95个候选化合物。
然后,通过比较95种候选化合物与阳性对照BMS202(小分子抑制剂)的同质时间分辨荧光(HTRF)信号水平,研究人员确定了16种可以抑制PD-1/PD-L1信号通路的候选化合物。根据剂量反应性和化合物稳定性,剩下10种候选化合物。
参考BMS202的作用模式,研究人员假设候选化合物与PD- L1的组合可以使PD-L1更加稳定。他们通过热变性实验验证了这一点,发现上述10个候选化合物可以提高PD-L1的热稳定性3-4。随后,研究人员通过梯度光谱核磁共振(WaterLOGSY NMR)验证了这些候选化合物与PD-L1的结合能力,并获得了最有前景的小分子抑制剂SM69。
这些结果表明候选化合物具有与BMS202相似的作用模式,并且可以通过结合PD-L1干扰其与PD-1的相互作用。
仅通过化学检测无法确认其生物效应。为此,研究人员对上述10种候选化合物进行了体外测试。通过细胞代谢活性实验评价这些化合物对人MDA-MB-231和黑素瘤A375细胞的细胞活力的影响。同时,评价它们对内皮细胞HMEC的毒性,以模拟脱靶引起的全身毒性。经过上述实验,研究人员最终筛选出6种潜在的PD-L1小分子抑制剂。
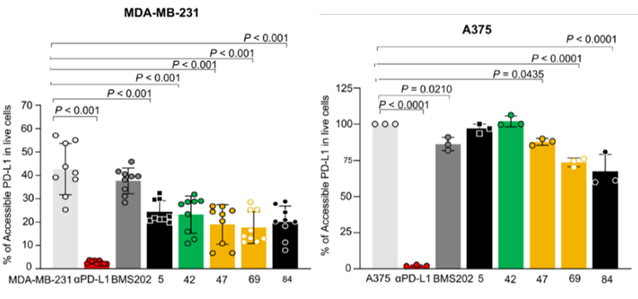
候选化合物调节PD-1/PD-L1相互作用
随后,抗PD-L1抗体用作对照,MDA-MB-231和A
375上评估了上述小分子抑制剂对PD-1/PD-L1相互作用的影响,发现大部分化合物对PD-L1有影响,但效果均弱于抗PD-L1抗体。与前述依靠化学检测手段筛选的结果一致,SM69对PD-L1的抑制效果最佳。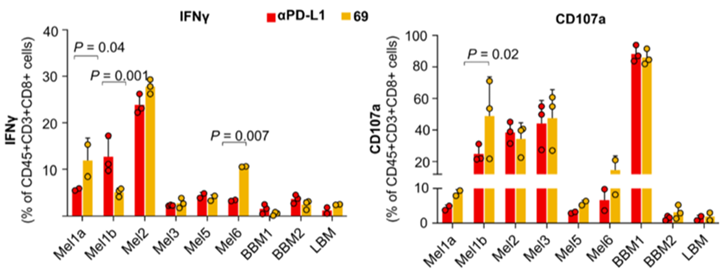
SM69诱导T细胞激活
为了测试SM69对PD-1/PD-L1抑制以及T细胞活化的影响,研究人员使用患者来源的外周血单个核细胞(PBMC)及其自体肿瘤细胞进行2D共培养实验。
通过检测共培养后T细胞的PD-1,IFN- 及CD107a的表达水平,研究人员发现SM69与抗PD-L1抗体均能抑制T细胞PD-1表达,上调其IFN- 及CD107a的表达。此外,虽然SM69与抗PD-L1抗体都能抑制抗原呈递细胞(APC)的PD-L1表达,但只有前者能够提高APC的比例。
随后,研究人员利用患者来源的黑素瘤细胞及其自体PBMC建立了3D肿瘤球,来验证SM69与抗PD-L1抗体处理对离体T细胞浸润肿瘤球的影响。结果表明,与未经处理组及抗PD-L1抗体处理组相比,SM69对PD-1/PD-L1的抑制导致肿瘤球内CD8+T细胞浸润更多。
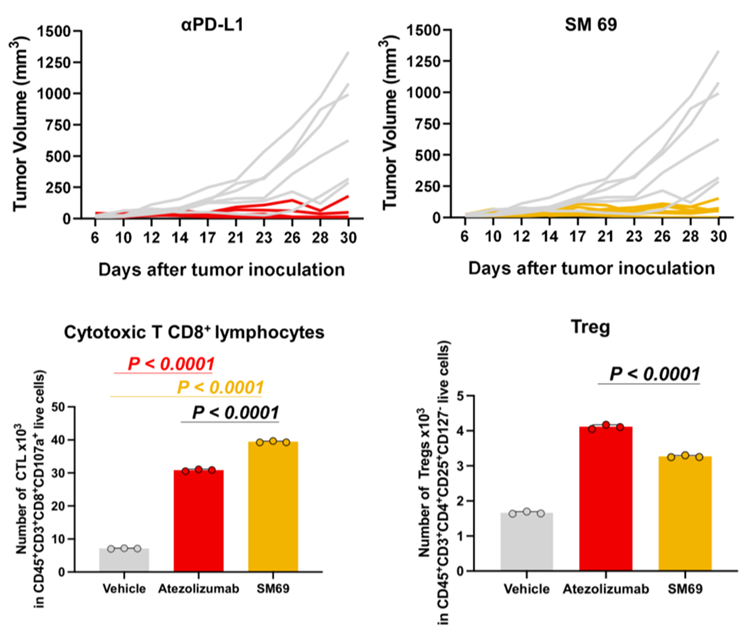
体内抗肿瘤实验及TME分析
仅仅依靠小鼠T细胞离体再培养实验无法模拟体内复杂的情况,还无法准确验证SM69的效果。
为此,研究人员在人源化PD-1的小鼠体内建立了表达人源化PD-L1的模型(MC38-hPD-L1),并以10 mg/kg的剂量连续腹腔注射SM69共计10天。
结果表明SM69与阿替利珠单抗类似,均显著抑制肿瘤生长,且无明显的系统毒性。而通过与阿替利珠单抗治疗后小鼠TME中的T细胞对比,研究人员发现SM69的治疗诱导了更高水平的CD107a+CTL和更低水平的Treg细胞浸润。
总而言之,为了制备针对PD-1/PD-L1信号通路的有效小分子抑制剂,研究人员使用了计算机辅助筛选的方法。基于人PD-L1蛋白晶体结构,他们从合成化合物库中虚拟筛选了近90万种化合物,并最终识别出了95种候选化合物。随后,研究人员利用一系列化学检测手段筛选出最具潜力的小分子抑制剂。接下来,他们利用体外PD-1/PD-L1相互作用验证,证明了SM69可以成功抑制PD-1/PD-L1相互作用。最后,利用2D和3D黑色素瘤、乳腺癌细胞与离体T细胞共培养实验验证,体内抗肿瘤实验及TME分析,研究人员再次确认了SM69可以成功抑制PD-1/PD-L1相互作用,激活T细胞的功能,并在体内将CTL招募到TME,从而抑制肿瘤生长。
这项工作再次证明了设计小分子免疫检查点抑制剂的可能性。小分子抑制剂可以克服单克隆抗体有限的TME扩散,难以靶向其他细胞PD-L1的限制,这可能引起免疫治疗的革新。此外,小分子抑制剂的生产成本普遍较低,使得其具有更高的临床应用可能。
参考文献:
[1] Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015;27(4):450-461. doi:10.1016/j.ccell.2015.03.001
[2] Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med. 2012;366(26):2455-2465. doi:10.1056/NEJMoa1200694
[3] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264. Published 2012 Mar 22. doi:10.1038/nrc3239
[4] Zhan MM, Hu XQ, Liu XX, Ruan BF, Xu J, Liao C. From monoclonal antibodies to small molecules: the development of inhibitors targeting the PD-1/PD-L1 pathway. Drug Discov Today. 2016;21(6):1027-1036. doi:10.1016/j.drudis.2016.04.011
[5] Ac rcio RC, Pozzi S, Carreira B, et al. Therapeutic targeting of PD-1/PD-L1 blockade by novel small-molecule inhibitors recruits cytotoxic T cells into solid tumor microenvironment. J Immunother Cancer. 2022;10(7):e004695. doi:10.1136/jitc-2022-004695
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- PNAS:免疫疗法新突破!NOD2基因变异助力癌症治疗 (2025-08-06)
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















