杜氏肌营养不良(DMD)新药!第一个游离类固醇vamorolone申请在欧盟上市! |
 |
来源:100医疗网原创2022-10-19 11:50
Vamorolone是一类新药,其受体与皮质类固醇相同,但改变了受体的下游活性,因此被认为是一种“解离型”抗炎药物。

图片来源:图片网
2022年10月19日/100医学网BIOON/——瑞士Santhera制药公司近日宣布,已向欧洲药品管理局(EMA)提交了用vamorolone治疗杜氏肌营养不良症(DMD)的上市授权申请(MAA)。在美国,该公司预计在2022年第四季度向美国美国食品药品监督管理局(FDA)提交vamorolone用于DMD的新药申请(NDA)。
Vamorolone是第一类具有新作用模式的游离类固醇。在美国和欧洲获得了治疗DMD的孤儿药资格(ODD),并获得了美国FDA的快速通道资格(FTD)和罕见儿科疾病资格(RPDD),以及英国药品和健康产品管理局(MHRA)的潜在创新药物(RPDD)
杜氏肌营养不良症(DMD)是一种罕见的遗传性X染色体连锁疾病,几乎只影响男性。DMD的特点是出生时或出生后不久出现炎症反应,导致肌肉纤维化。其临床表现为进行性肌肉变性和无力。DMD疾病进展的关键里程碑包括失去行走能力、失去自我进食、开始辅助通气和发展为心肌病。由于呼吸和/或心力衰竭,DMD患者的预期寿命通常不超过40年。
Vamorolone由美国ReveraGen生物制药公司研发。2020年9月2日,Santhera行使其选择权,获得了vamorolone治疗DMD和所有其他适应症的全球权利。
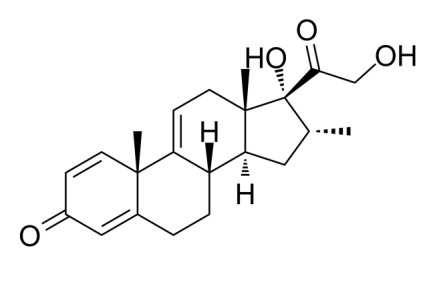
vamorolone的分子结构式(来源:medchemexpress.com)
Vamorolone为一类药物,与皮质类固醇结合的受体相同,但改变了受体的下游活性,因此被认为是解离型抗炎药物。这一机制显示了将疗效与类固醇安全性分开的可能性。因此,vamorolone有潜力成为现有皮质类固醇的有价值的替代品。目前,皮质类固醇是儿童和青少年DMD的标准护理疗法。但由于大剂量皮质类固醇的严重全身副作用,会降低患者的生活质量,这部分患者的医疗需求远未得到满足。
MAA提交的核心是来自关键的2b期VISION-DMD研究的阳性数据,包括:(1)24周评估VAMORONE (2和6 mg/kg/天)、泼尼松(0.75 mg/kg/天)和安慰剂的疗效和安全性,然后(2)24周评估疗效的维持并收集更多长期安全性和耐受性数据。此外,该MAA还包括来自3项开放性研究的数据,其中vamorolone的剂量为2至6mg/kg/天,总治疗期长达30个月。
在关键的VISION-DMD研究中,在治疗的第24周:与安慰剂相比,vamorolone达到了主要终点站立时间(TTSTAND)速度(p=0.002),并表现出良好的安全性和耐受性。在这项研究中,与安慰剂相比,vamorolone最常见的不良反应是库欣样症状、呕吐和维生素D缺乏。不良事件通常为轻度至中度。(100yiyao.com 100医疗网)
原始资料来源:Santa向欧洲药品管理局提交了杜氏肌营养不良疫苗的上市许可申请
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- PNAS:免疫疗法新突破!NOD2基因变异助力癌症治疗 (2025-08-06)
- 《自然· 医学》:按照膳食指南吃可能还不够!最新临床试验显示,即使遵照指南要求吃饭,多吃超加工食品仍会阻碍减重 (2025-08-06)
- 施一公团队发表最新PNAS论文 (2025-08-06)
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















