Cell:重磅!发现第四种基因转导机制!揭示噬菌体介导细菌有害基因转导的新机制 |
 |
来源:100医药网原创 2023-08-08 09:30
在一项新的研究中,来自新加坡国立大学和英国帝国理工学院的研究人员发现了细菌传播它们的基因的一种新方式,这种方式使细菌的进化速度远远超过了人们以前的理解。这一新见解可能有助于科学家们更好地理解致病细菌如在一项新的研究中,来自新加坡国立大学和英国帝国理工学院的研究人员发现了细菌传播它们的基因的一种新方式,这种方式使细菌的进化速度远远超过了人们以前的理解。这一新见解可能有助于科学家们更好地理解致病细菌如何进化并变得毒性越来越强、对越来越耐药。相关研究结果发表在2023年8月3日的Cell期刊上,论文标题为 Dual pathogenicity island transfer by piggybacking lateral transduction 。论文通讯作者为新加坡国立大学医学院微生物学与学系助理教授John Chen博士和帝国理工学院传染病系教授Jos R. Penad s博士。

共享遗传物质的能力是微生物进化的主要驱动力,因为它可以在瞬间将良性细菌转化为致命的病原体。作为感染细菌的病毒,噬菌体可以作为管道,通过一种称为基因转导(genetic transduction)的过程,使基因从一个细菌转移到另一个细菌。
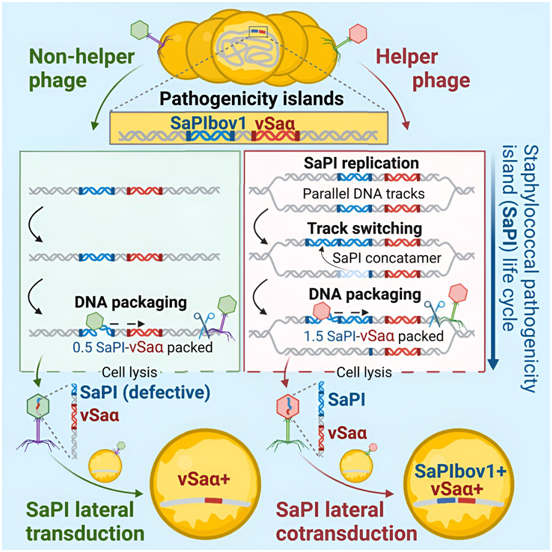
目前,已知的转导机制有三种:普遍性转导(generalized transduction)、局限性转导(specialized transduction)和侧向转导(lateral transduction)。侧向转导也是由同一组研究人员在 2018 年发现的(Science, 2018, doi:10.1126/science.aat5867,详细报道参见新闻:),其效率至少是下一个最强大的转导机制---普遍性转导---的1000倍。
这种新的转导过程被称为侧向共转导(lateral cotransduction),这种细菌进化新频率和速度背后的设计师是金黄色葡萄球菌致病性岛(Staphylococcus aureus pathogenicity island, SaPI)。SaPI是一种利用和寄生噬菌体的自私DNA元件,通常被发现整合在金黄色葡萄球菌分离株的染色体中。
金黄色葡萄球菌是一种可导致人类和动物感染葡萄球菌的细菌。虽然它主要表现为皮肤感染,但如果扩散到血液中并感染器官、骨骼或关节,就会危及生命。
Penad s说, 这一突破揭示了细菌进化的新途径。鉴于抗生素耐药性超级细菌的激增令人震惊,理解驱动细菌进化的机制变得越来越重要。
这种新发现的转导过程---侧向共转导---在效率上可与侧向转导相媲美,但在多功能性和复杂性上却超过了后者。据了解,侧向转导只发生在细菌基因组中的休眠噬菌体被重新激活并在溶菌周期(lytic cycle)中开始增殖的时候,而侧向共转导则可能发生在休眠噬菌体重新激活过程和感染新细菌细胞的过程中。
此外,与牺牲自身基因来传递细菌宿主 DNA 的噬菌体不同,SaPI可以通过侧向共转导将自身与细菌 DNA 完全完整地传递。这种非凡的能力使它们能够永久地重复这一过程,从而大大提高了传播细菌基因的效力和效率。
图片来自Cell, 2023, doi:10.1016/j.cell.2023.07.001。
Chen说, 通过这项新的研究,我们证实细菌的进化速度比我们想象的要快得多。虽然基因转导一直是噬菌体的专属领域,但具有讽刺意味的是,我们的研究显示,地球上最多产的寄生物(噬菌体)很可能是目前已知的最强大、最高效的转导剂。
新加坡国立大学医学院副院长Chng Wee Joo教授说, 这一突破性发现将影响我们对细菌如何通过基因转移进化的理解,以及它们对细菌感染和疾病的潜在影响。这项新的研究也是临床安全治疗决策的重要依据。
超级细菌的崛起呼唤着治疗抗生素耐药菌株的新方法。噬菌体疗法就是近年来备受关注的一种方法,它利用噬菌体消灭感染和疾病中的有害细菌。然而,一些治疗性噬菌体不仅能消灭细菌,还可能在不知情的情况下成为SaPI或其他能够侧向共转导的相关序列元件的帮凶。
Penad s说, 这一过程也可能发生在其他一系列细菌物种中。这一突破性发现标志着我们对细菌进化的理解发生了革命性变化,并将极大地影响我们抗击抗生素耐药性的方式。
Chen说, 它们(噬菌体)可以在短期内被用来消灭细菌,但从长远来看,最终会将有害基因传播到其他细胞,这可能被证明是灾难性的。有了这种了解致病生物进化机制的新方法,治疗性噬菌体在用于治疗之前必须经过仔细审查。 (100医药网 100yiyao.com)
参考资料:
Melissa Su Juan Chee et al. . Cell, 2023, doi:10.1016/j.cell.2023.07.001.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Science:新研究开发出世界上最全面的蝙蝠类器官平台 (2025-05-29)
- 以治促防!抗流感新药可显著降低流感传播风险,流感防治策略有望迎来革命性变化 (2025-05-29)
- Cell Metab:索马鲁肽引起的体重减轻与大脑中的神经细胞有关 (2025-05-28)
- Nature Biotechnology:D (2025-05-28)
- 2025金笔奖征文投票环节火热进行中!快来投票支持您喜爱的制药原创文章 (2025-05-28)
- 鹏瑞利集团与广州地铁集团签署协议 在广州设立华南首家外商独资三级综合医院 (2025-05-28)
- Nature:揭秘“半胱氨酸断食法”,一周暴瘦30%的科学奥秘! (2025-05-28)
- 《神经病学》:复旦学者发现,超加工食品与帕金森病的非运动前驱症状风险升高147%有关! (2025-05-28)
- 8篇Cell及其子刊论文构建出一系列增强子AAV载体,用于研究大脑疾病 (2025-05-27)
- NMPA获批!全球首创!先健主动脉原位开窗分支重建创新产品矩阵上市 (2025-05-27)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















