2024年6月Science期刊精华 |
 |
来源:100医药网 2024-06-30 12:55
重大突破!Science:我国科学家发现抗疟药物青蒿素有望用于治疗多囊卵巢综合征、利用优化的肺靶向脂质纳米颗粒进行肺干细胞基因编辑,有望治疗囊性纤维化2024年6月份即将结束,6月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.
doi:10.1126/science.adk5382
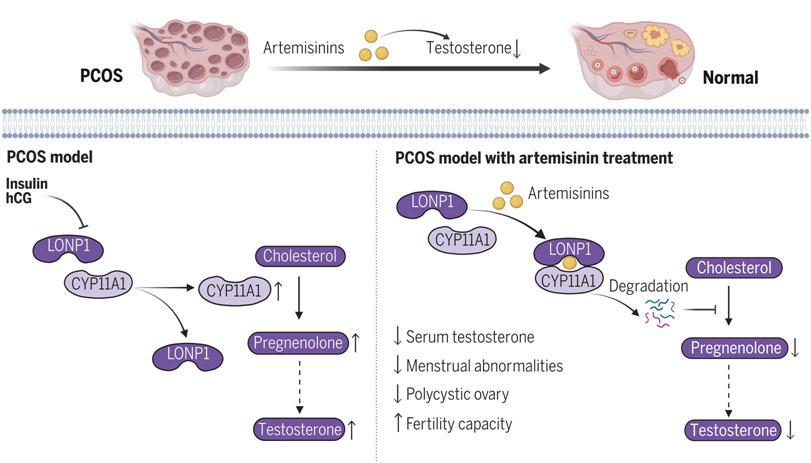
在一项新的研究中,来自中国复旦大学、重庆医科大学和中国药科大学的研究人员通过评估青蒿素衍生物对睾酮水平、发情周期和多囊卵巢形态的影响,探讨了青蒿素类药物在啮齿类多囊卵巢综合征样模型和人类多囊卵巢综合征患者中的治疗潜力。他们采用体外和体内方法研究了青蒿素对卵巢睾酮合成的影响,还鉴别出了青蒿素作用的直接分子靶标,揭示了其调节雄激素合成的机理。相关研究结果发表在2024年6月14日的Science期刊上,论文标题为 Artemisinins ameliorate polycystic ovarian syndrome by mediating LONP1-CYP11A1 interaction 。论文通讯作者为复旦大学的汤其群教授。
图片来自Science, 2024, doi:10.1126/science.adk5382
研究者们发现,青蒿素的一种衍生物,蒿甲醚,能显著逆转多囊卵巢综合征(PCOS)模型动物中的多种症状,包括雄性激素过高、月经周期不规律、卵巢多囊样改变及生育力下降。青蒿素类药物通过减少卵巢内睾酮的产生,有效缓解了雄性激素过高的状况。利用蛋白质组学分析,他们发现,青蒿素作用后显著降低了一种关键蛋白 参与雄激素合成首步反应的细胞色素P450家族11亚家族A成员1(CYP11A1)。
从机理上讲,青蒿素类药物直接靶向离子肽酶1(lon peptidase 1, LONP1),增强了 LONP1 与 CYP11A1 之间的相互作用,促进了由 LONP1 催化的 CYP11A1 降解。相反,雄激素诱导剂会破坏 LONP1 与 CYP11A1 之间的结合。此外,LONP1 在多囊卵巢综合征中表现为明显下调,导致 CYP11A1 水平升高和雄激素合成增加。蛋白对接模拟和随后的功能实验表明青蒿素类药物对 CYP11A1 水平的抑制作用主要取决于它们与 LONP1 蛋白水解结构域的直接结合。进一步支持上述功能的是,LONP1的过表达能强有力地减少卵巢雄激素生成,这与青蒿素类药物的作用效果相符。
最后,为了证实青蒿素类药物对多囊卵巢综合征患者的治疗效果,研究人员进行了一项试点临床试验。他们发现双氢青蒿素(dihydroartemisinin)治疗可有效改善多囊卵巢综合征患者的高雄激素血症,降低抗缪勒氏管激素水平,改善多囊卵巢形态,并有助于月经恢复正常。
2.
doi:10.1126/science.adk9428
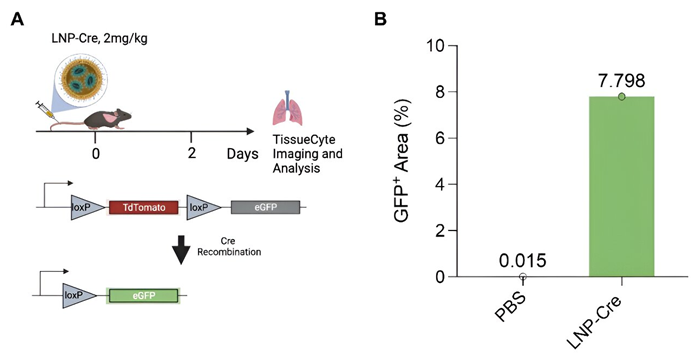
体内基因组校正有望产生持久的疾病治愈效果;然而,有效的干细胞编辑仍具有挑战性。在一项新的研究中,来自德克萨斯大学西南医学中心、凯斯西储大学医学院和 ReCode Therapeutics 公司的研究人员开发出了一种将基因编辑工具递送到肺部中以修复与囊性纤维化(cystic fibrosis)相关的CFTR基因缺陷的方法。在此过程中,他们克服了阻碍以往疗法的问题,并且相信他们的方法很快就能用于治疗人类患者。相关研究结果发表在2024年6月14日的Science期刊上,论文标题为 In vivo editing of lung stem cells for durable gene correction in mice 。
图片来自Science, 2024, doi:10.1126/science.adk9428
具体而言,这些作者证实优化的肺靶向脂质纳米颗粒(lipid nanoparticle, LNP)能够在肺干细胞中进行高水平的基因组编辑,产生持久的反应。在可激活的tdTomato小鼠体内实现基因编辑的LNP,可实现70%以上的肺干细胞编辑,在80%以上的肺上皮细胞中维持tdTomato表达660天。就囊性纤维化而言,NG-ABE8e信使核糖核酸(mRNA)-sgR553X LNP介导了 95%的CFTR DNA校正,恢复了源自原发性患者的支气管上皮细胞的CFTR功能,校正了肠道类器官,并校正了囊性纤维化小鼠模型体内50%肺干细胞中的R553X无义突变。这些发现引入了通过LNP实现的组织干细胞编辑,用于缓解疾病的基因组校正。
3.
doi:10.1126/science.adf1329
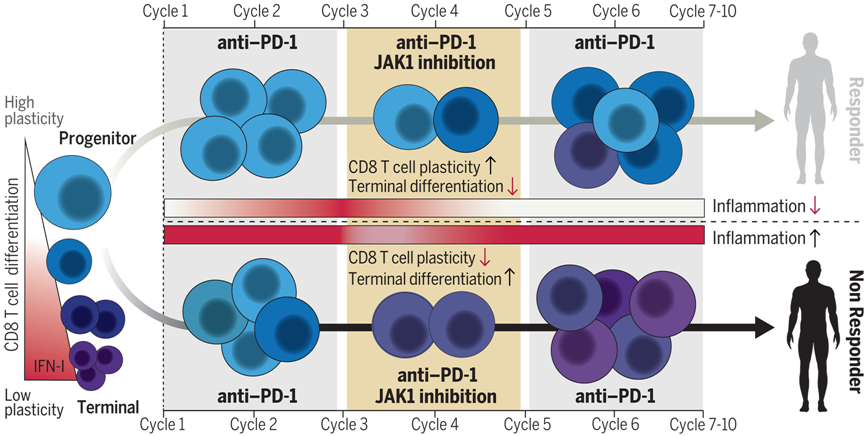
在一项新的小型临床试验中,来自宾夕法尼亚大学佩雷尔曼医学院等研究机构的研究人员发现在抗PD1免疫检查点抑制剂免疫疗法中加入一种抗炎药物很有可能成为一种治疗晚期肺癌的新策略。基于不断积累的证据,这一发现展示了炎症的双重性 在短期内有助于抵抗感染性病原体和癌症,但当炎症变成慢性炎症时,也会导致免疫系统衰弱。相关研究结果发表在2024年6月21日的Science期刊上,论文标题为 Combined JAK inhibition and PD-1 immunotherapy for non small cell lung cancer patients 。
图片来自Science, 2024, doi:10.1126/science.adf1329
这种慢性炎症反应的迹象,尤其是涉及一种名为干扰素(interferon)的细胞因子的迹象,经常出现在服用抗癌免疫疗法的患者身上,并且与较差的预后有关。
在这项新的研究中,这些作者使用了一种名为JAK1抑制剂的药物,专门减少持续的炎症信号传导,同时不干扰产生抗肿瘤活性所需的初始炎症信号传导。21名晚期()患者接受了为期六周的JAK1抑制剂治疗,但只有在接受了两剂抗PD1免疫检查点抑制剂免疫疗法后才会出现反应。他们的结果表明总反应率达到67%,中位无进展生存期接近24个月,这两项指标对于晚期非小细胞肺癌来说都非常高。
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院放射肿瘤学教授Andy Minn博士说, 许多肿瘤学家可能会对将JAK抑制剂与免疫疗法相结合感到惊讶,因为通常情况下,抗PD1免疫检查点抑制剂治疗的重点在于产生强烈的炎症反应。然而,人们越来越认识到,慢性炎症,尤其是慢性干扰素,可能是有害的。我们这项研究中的高反应率和免疫细胞的改善表明,我们的方法可能有助于在炎症和干扰素水平变得有害之前对其进行控制。
4.
doi:10.1126/science.ade8520
免疫检查点抑制剂疗法可被视为解除癌症对免疫系统的抑制。这些药物能消除阻碍免疫系统识别和靶向体内的蛋白屏障。虽然有多种免疫检查点抑制剂被批准用于治疗不同类型的癌症,但许多患者对现有疗法没有反应或产生抗药性。
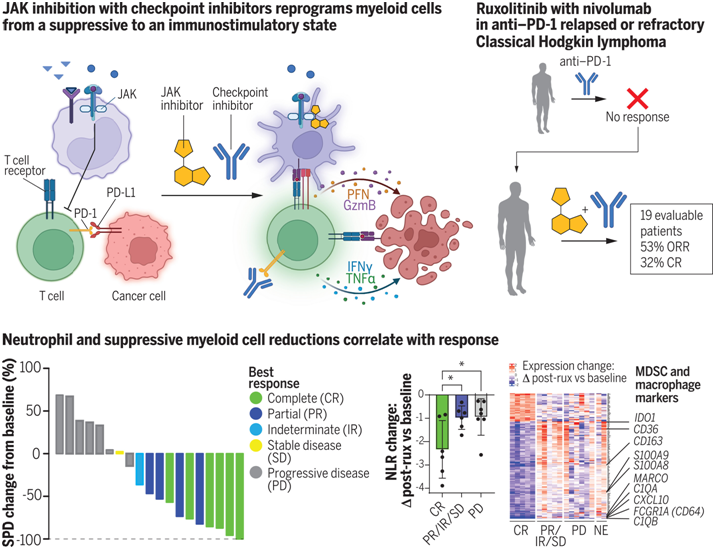
如今,在一项新的研究中,来自斯克里普斯研究所的研究人员发现,当与免疫检查点抑制剂同时使用时,已获批准的免疫抑制药物鲁索替尼(ruxolitinib)能增强T细胞的反应,从而提高它们的抗癌效果。这些发现得到了一项针对患者的1期临床试验以及临床前模型的支持。相关研究结果发表在2024年6月21日的Science期刊上,论文标题为 JAK inhibition enhances checkpoint blockade immunotherapy in patients with Hodgkin lymphoma 。
图片来自Science, 2024, doi:10.1126/science.ade8520
T细胞由免疫系统产生,用于抵御感染和癌症。当患者的T细胞开始衰退时,他们往往对免疫检查点免疫疗法不再有反应。这种被称为T细胞衰竭(T-cell exhaustion)的现象发生在T细胞长期暴露于癌细胞的情况下。但基于之前的研究成果,Teijaro和他的研究团队想知道JAK抑制剂,比如鲁索替尼,是否能增加T细胞的生成,同时改善免疫检查点抑制剂及其 抑制解除 效应。
这些作者通过一系列临床前模型(患有不同类型癌症的小鼠和遭受持续性病毒感染的小鼠)发现,与单独使用免疫检查点疗法相比,与鲁索替尼联合治疗可增加T细胞和自然杀伤(NK)细胞,另一种限制癌症扩散的免疫细胞--的数量。
5.
doi:10.1126/science.adh8967
细胞毒性T细胞是机体免疫系统的重要组分,一旦被激活,其就会分化为短期效应细胞或长期记忆细胞。近日,一篇发表在国际杂志Science上题为 Cellular architecture shapes the na ve T cell response 的研究报告中,来自苏黎世联邦理工学院等机构的科学家们通过研究发现,接受病原体诱导的激活时,T细胞的细胞架构或会影响其所采用上述两种功能中的一种。相关研究结果不仅能帮助改善科学家们对机体免疫系统的理解,还有望帮助开发更好的癌症疗法。
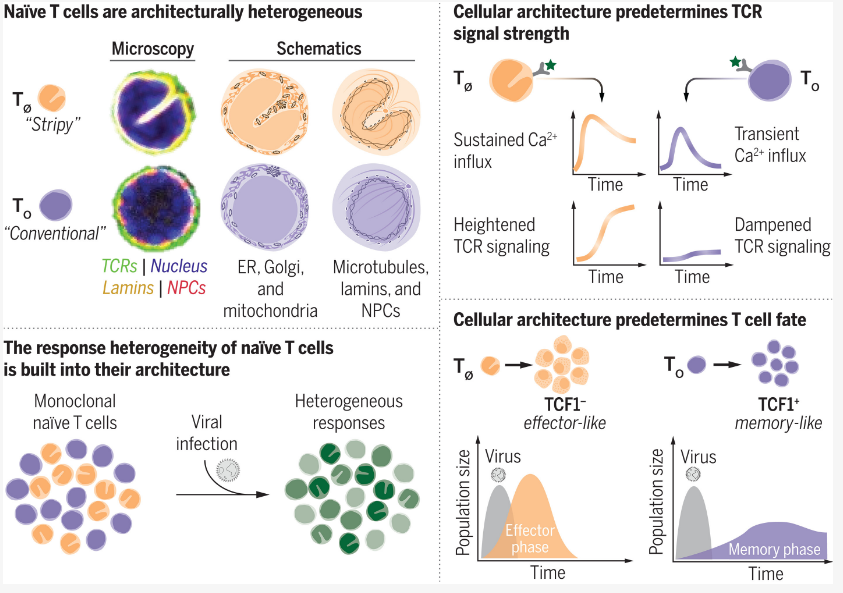
科学家识别出机体免疫细胞内部运作的关键差异
图片来源:Science (2024). DOI:10.1126/science.adh8967
从外部来看,大多数T细胞看起来都一样:小且呈现球状。这项研究中,研究人员利用先进的技术仔细观察了这些细胞,结果发现,细胞毒性T细胞的亚细胞空间组织(研究者将其称之为细胞结构)对其命运有着重大影响。当发生细胞核内陷的细胞遭遇病原体时,其就会转变成为强大的效应细胞,从而快速增殖并杀灭病原体,携带球状核的同类细胞(也就是不发生核内陷)则会以一种优先的速度进化,其需要较长的时间来激活并最终分化为长期记忆细胞,从而保护机体抵御相同病原体的后期攻击。
大约50年前,科学家们识别出了两种功能不同的T细胞,但直到目前为止,他们并不确定哪些特性能决定T细胞变为效应细胞或记忆细胞;为了帮助识别出这些特征,研究人员开发出了一种新型平台,其能自动分析免疫细胞的显微图像,随后他们将来自24名健康志愿者机体中数千个T细胞置于这一平台上进行分析,这些志愿者将其血液捐献给了瑞士红十字会的献血中心。
利用机器学习方法,这一平台能将细胞分为三种不同的群,研究人员也已经看到了一些T细胞在被激活时如何呈现出瓶状的,但他们并没有想到该平台会将圆形细胞分为两个不同的群。进一步研究后,研究人员发现,这两类圆形细胞在细胞架构上的差异或许也具有一定的功能意义,细胞核内陷的细胞会被设计成快速激活,其中很多细胞都会在24小时内转变成瓶状效应细胞,当被激活时其会产生强烈的反应,而且要比没有发生核内陷的细胞增殖地更快;如今研究人员还识别出了导致核内陷细胞快速且强烈激活的分子机制,其特殊的细胞架构会促使钙离子的流入水平增加。
6.
doi:10.1126/science.adk0850; doi:10.1126/science.adk0775
近日,发表在国际杂志Science上的两篇研究报告中,来自北卡罗来纳大学Lineberger综合癌症研究中心等机构的科学家们通过研究描述了关键的致癌基因(癌基因)KRAS作用原理的最全面的分子特征,同时还阐明了KRAS活性如何影响胰腺癌患者治疗结局,相关研究结果或有望为开发新型胰腺癌疗法提供更多的信息。
胰腺癌是美国人群所有癌症死亡的第三大原因,研究者Channing J. Der博士说道,由于不到40%的胰腺癌会对KRAS抑制剂疗法产生反应,如果我们能建立特殊的分子标记来预测哪些患者会产生反应,我们就能更好地为其提供特殊的疗法从而改善治疗结局。从到死亡,接受化疗治疗的胰腺癌患者的平均存活时间为6至12个月,因此为患者提供有效治疗的时间非常有限。
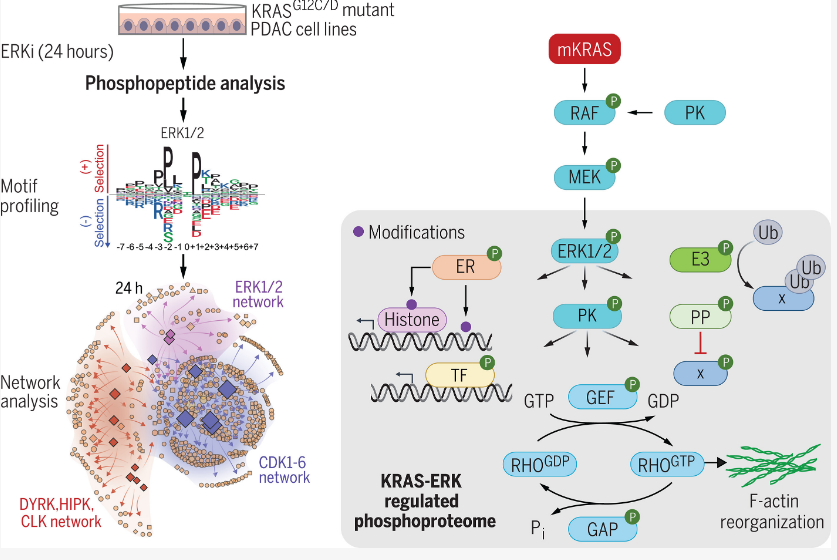
科学家详细描述影响人类胰腺癌进展和疗法反应的特殊分子通路
图片来源:Science (2024). DOI:10.1126/science.adk0850
KRAS是人类癌症中最常发生突变的基因,其能在超过90%的胰腺癌肿瘤中被发现,然而,研究人员并不是非常清楚其如何刺激癌症进展,这就是为何本文研究人员开始进行广泛的研究从而阐明哪些其它基因和蛋白质会促使KRAS表达如此致命的原因了。在迄今为止最详细的分析中,研究人员阐明,最负责KRAS癌症驱动功能的分子通路高度依赖于一种名为ERK的蛋白,这种蛋白在调节哪些基因表达以及那些基因活跃方面发挥着双重功能。
尽管ERK一直是科学家们研究最深入的癌症通路之一,而且如今他们已经确定了ERK是KRAS发挥功能的重要参与者,但其相对重要性以及ERK是如何发挥作用的,研究人员并不清楚。的确,研究人员的核心发现是,ERK蛋白的单独激活是对抑制KRAS的药物产生耐受性的关键驱动因素;利用改进的方法来研究细胞信号通路,研究人员就表明,ERK蛋白能调节数千种基因非常复杂的表达,且会改变数千种蛋白质的活性。
让研究人员兴奋的是,目前他们已经证实,在癌症模型研究中的发现能准确反映接受ERK和KRAS疗法治疗胰腺癌、和肺癌患者的反应。目前已经有两种KRAS药物获批用于癌症治疗,而且还有很多药物正在进行临床试验,在相关研究中,研究者Der等人4月发表在Nature杂志上的研究中就提出了一种非常有潜力的抗KRAS药物,其能有效抵御多种不同的KRAS突变。
7.
doi:10.1126/science.adn6541
在一项新的研究中,来自德国柏林洪堡大学、波茨坦大学、瑞典于默奥大学和乌普萨拉大学的研究人员利用低温电镜,成功地以前所未有的纳米级分辨率可视化观察到光合作用过程中的原子结构。他们特别研究了一种称为光系统 II(photosystem II)的蛋白结构,光合作用的第一步就是在光系统 II 中进行的:光被吸收并用作能量源,驱动水分子分裂成氧、质子和电子。相关研究结果发表在2024年6月21日的Science期刊上,论文标题为 Cryo electron microscopy reveals hydrogen positions and water networks in photosystem II 。
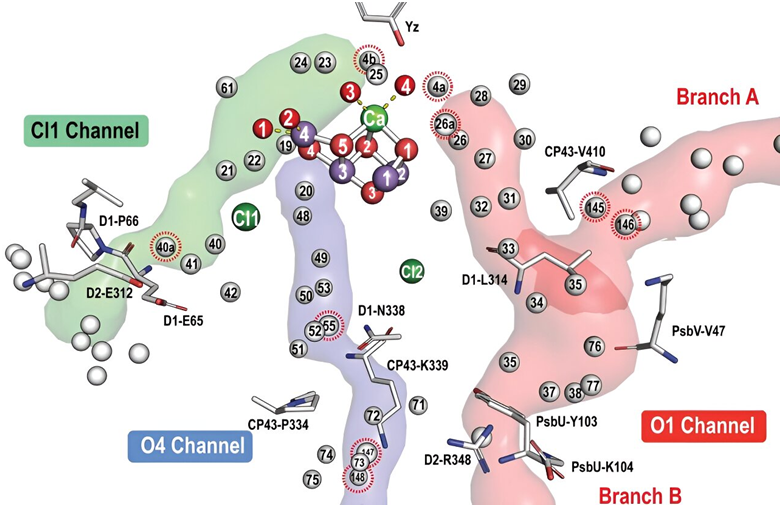
图片来自Science, 2024, doi:10.1126/science.adn6541
这种高分辨率可视化技术为人们提供了有关光系统 II 中氢相互作用的新见解,其中这些相互作用对于光能驱动的反应至关重要。因此,在柏林洪堡大学生物系的 Rana Hussein 博士和 Athina Zouni 教授、于默奥大学的 Wolfgang Schr der 教授和乌普萨拉大学的 Johannes Messinger 教授的领导下,这些作者在了解复杂的光合作用过程方面迈出了重要的一步。
Zouni说, 通过使用低温电镜,我们如今可以观察到光系统 II 中氢的位置。这种细致的观察对于了解氧气进化生物将光能转化为化学能的过程至关重要---这一过程是地球上生命的基础。
柏林洪堡大学的Holger Dobbek 教授详细解释说, 我们使用低温电镜以更高的分辨率显示光系统 II。这使我们能够检测到光系统 II的反应中心位点中的几个氨基酸残基中的氢,从而提供了有关光系统 II 中电子和质子传递的新信息。我们的研究揭示了一系列导致移动质体醌B(plastoquinone B)第二次质子化的事件,这深刻地更新了我们对光合作用中电子传递链的理解。
8.
doi:10.1126/science.adh9979
要了解人体器官的功能和,需要详细绘制细胞的解剖和分子结构及其全器官连接性(organ-wide connectivity)。成像和分子分析技术的进步极大地丰富了科学家们对人体器官内功能区域和细胞解剖结构及其分子特性的了解。然而,人们仍然缺乏能够全面捕捉单个细胞的多尺度多组学特性及其全器官连接性的技术。
在一项新的研究中,来自麻省理工学院等研究机构的研究人员开发出一种可扩展的技术平台:MEGAtome(mechanically enhanced great-size abrasion-free vibratome, 机械增强型大尺寸无磨损振动切片机),用于同时绘制全器官结构图和高维特征图,包括从同一组织获取的细胞的分子、形态和连接性信息。该平台包括一种保持连接性的组织切片的机械装置、一种可实现多通道多尺度分子成像的组织理化特性工程化学技术,以及一种用于单细胞投影组绘图的计算工具。他们充分整合了机械、化学和计算工具,实现了人体器官级组织的高度多重多尺度分子表型分析。相关研究结果发表在2024年6月14日的Science期刊上,论文标题为 Integrated platform for multiscale molecular imaging and phenotyping of the human brain 。
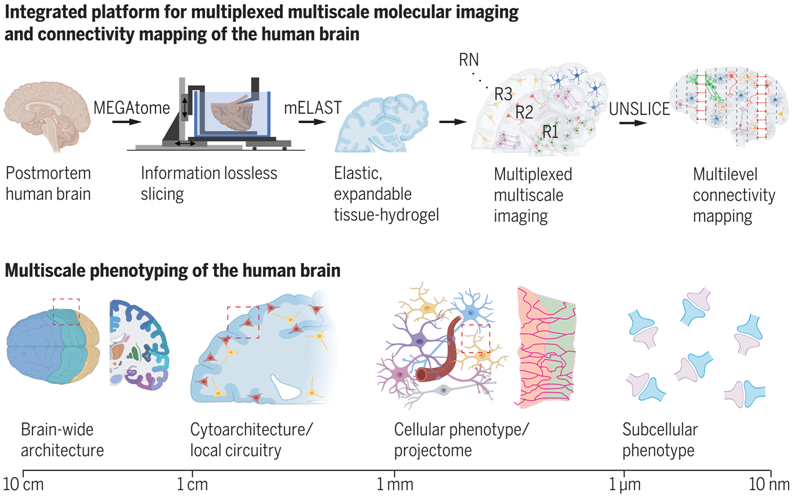
图片来自Science, 2024, doi:10.1126/science.adh9979
由于MEGAtome优化了叶片振动控制,这种多自由度(multi degree of freedom, DOF)系统能够对超大型生物系统进行精确切片,同时最大限度地减少连接性信息的损失。MEGAtome 切片和光片成像技术为超大型样本(如完整的冠状人脑片和队列级动物器官阵列)的高通量分子图谱绘制提供了便利。
这种基于水凝胶的集成组织处理方法被称为 mELAST(magnifiable entangled link-augmented stretchable tissue-hydrogel, 可放大纠缠链路增强可拉伸组织-水凝胶),将生物组织转化为弹性、透明和可膨胀的水凝胶,同时保留了内源性生物分子和纳米细胞结构。mELAST与 SWITCH(system-wide control of interaction time and kinetics of chemicals, 化学物相互作用时间和动力学的全系统控制)介导的快速染色方法相结合,实现了完整人体脑组织的高度多通道多尺度成像。
UNSLICE(unification of neighboring sliced-tissues via linkage of interconnected cut fiber endpoints, 通过相互连接的切割纤维端点统一相邻的切片组织)促进了切片间的精确配准,从而利用免疫标记的细胞类型特异性纤维作为地标,在单纤维水平上重建切片组织块。随着数据集维度的增加,他们的这种策略的迭代性质使连接性映射的准确性不断提高。
他们应用这种集成技术平台分析了人类(AD)的多尺度病理,揭示了多种病理特征,包括细胞类型分布、形态特征、神经元纤维方向和化学突触分布的差异。利用 UNSLICE,他们在人脑中展示了单纤维分辨率的可扩展神经投射图谱,揭示了表达病理蛋白的神经纤维的投射模式。
9.菌
doi:10.1126/science.ado0713
了解影响植物病原菌传播的因素对于制定疾病预防策略至关重要。病原菌必须克服植物免疫防御、与微生物竞争并抵抗噬菌体才能定植于植物。宿主遗传特性会影响对病原菌的抑制作用,但周围微生物群的作用仍不清楚。广泛存在的噬菌体(称为细菌病毒)和噬菌体衍生成分会选择性杀死细菌。这些噬菌体衍生成分源自噬菌体祖先,靶向共同存在的细菌菌株,从而潜在地影响微生物群落。尽管它们普遍存在,但它们对植物微生物群和病原菌传播的影响在很大程度上仍然未知。
以前的研究已发现拟南芥的野生种群被遗传上多样的没有优势菌株的假单胞菌种群定殖。即使在单株植物中,绿黄假单胞菌(Pseudomonas viridiflava)感染也包括多种共存菌株。是什么阻止了单一致病菌谱系的传播?宿主免疫多样性可能会导致病原菌的多样性,但植物微生物组也可能起到一定作用。鉴于噬菌体和噬菌体衍生成分在假单胞菌种群中的普遍存在及其对特定菌株的杀伤活性,来自犹他大学和伦敦大学学院的研究人员在一项新的研究中假设对噬菌体成分的敏感性差异可能会抑制特定菌株。相关研究结果发表在2024年6月14日的Science期刊上,论文标题为 A phage tail like bacteriocin suppresses competitors in metapopulations of pathogenic bacteria 。
这些作者发现了一个丰富的病毒簇(viral cluster),它在不同的致病菌株中都是保守的。该病毒簇并不编码完整的噬菌体,而是编码tailocin,即一种会被细菌用来杀死竞争细菌的噬菌体衍生成分。每种致病性假单胞菌株都携带几种不同的tailocin变体之一,而这些变体靶向共生病原菌外膜上的可变多糖。对历史标本馆样本的分析表明,相同的tailocin和外膜变体在假单胞菌种群中至少存在了两个世纪,这表明一组确定的tailocin单倍型和受体仍在继续使用。这些研究结果支持这样一种模式,即在野生拟南芥种群中,tailocin和共生假单胞菌菌株的外膜正在协同进化。不同的tailocin和外膜单倍型在不同的时间和空间中得以保持。
10.
doi:10.1126/science.adp5577
在一项新的研究中,来自多伦多病童医院和多伦多大学等研究机构的研究人员首次利用多伦多病童医院纳米生物医学成像设备的先进成像技术,揭示了神经元用于沟通的V型三磷酸腺苷酶(vesicular-type ATPase, V-ATPase)的原子结构。相关研究结果于2024年6月20日在线发表在Science期刊上,论文标题为 High-resolution electron cryomicroscopy of V-ATPase in native synaptic vesicles 。
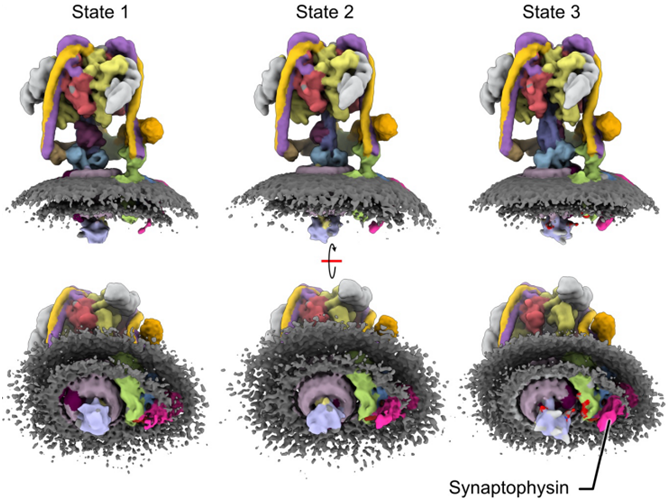
图片来自Science, 2024, doi:10.1126/science.adp5577
在论文通讯作者John Rubinstein博士和论文第一作者、Rubinstein实验室博士后研究员Claire Coupland博士的领导下,这些作者希望通过捕捉神经元释放化学物质的图像并建立模型,能够为新的治疗靶点提供信息,帮助改善对癫痫和其他神经疾病患儿的治疗。
神经元在沟通时,会向突触释放神经递质,将其传递给接收神经元。这些神经递质是从突触小泡(synaptic vesicle)中释放出来的。收到信息后,神经递质必须被重新吸收并重新包装到新的突触小泡中,以清除突触,为下一个信号腾出空间。为了促进这一过程,V-ATPase起到泵的作用,将神经递质驱动到突触小泡中。V-ATPase 还能调节突触小泡中的神经递质释放。(100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 金赛药业携手全球最大的脱敏治疗药企ALK,有望开启中国脱敏治疗新时代 (2025-09-18)
- Nature Methods:当百年病理学遇见AI——iSCALE赋能H&E图像,预测细胞级空间转录组 (2025-09-18)
- 《健康报》专访上海交通大学医学院海南国际医学中心数智医学研究院院长王慧:人工智能推动健康管理深度重构 (2025-09-18)
- Cell Stem Cell:血癌基因DNMT3A的惊人新角色!科学家解锁造血干细胞长寿的奥秘 (2025-09-18)
- 华人学者发表Nature论文,揭示这种基因突变为何会导致阿尔茨海默病 (2025-09-18)
- 为什么感冒鼻塞时,吃东西会没味道?最新Nat. Commun:原来味道不仅需要味觉,还需要嗅觉! (2025-09-18)
- 《自然·免疫学》:打破传统认知!大坪医院/昆明市延安医院团队从头设计多肽,精准抑制细胞焦亡孔道功能,为炎症治疗开辟新途径 (2025-09-17)
- 流感季不用慌!Sci Adv:“抗体鸡尾酒”抗多种毒株还不怕突变,感染5天给药仍能救命 (2025-09-17)
- 新疆放慢构建当代中药家当系统 (2025-09-17)
- 《免疫》:科学家首次发现,最毒乳腺癌在转移前就拿下了抗癌前哨! (2025-09-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















