Nature:新研究揭示RNA对DNA在细胞核中的包裹和解开至关重要 |
 |
来源:100医药网 2024-10-24 15:37
研究发现RNA通过一个名为TET2的基因,在DNA如何包装和储存在细胞中起着重要作用。在每个细胞内,在每个细胞核中,你的持续生存取决于一场极其复杂的舞蹈。蛋白不断地包裹和解开 DNA,这一过程中即使是微小的差错也可能导致癌症。在一项新的研究中,来自芝加哥大学和德克萨斯大学的研究人员揭示了这种舞蹈中一个以前不为人知的部分对人类健康有着重大影响。
相关研究结果于2024年10月2日在线发表在Nature期刊上,论文标题为 RNA m5C oxidation by TET2 regulates chromatin state and leukaemogenesis 。

具体而言,芝加哥大学的Chuan He教授团队和德克萨斯大学圣安东尼奥健康科学中心的Mingjiang Xu教授团队合作,发现RNA通过一个名为TET2的基因,在DNA如何包装和储存在细胞中起着重要作用。
这一途径似乎还解释了一个长期存在的难题,即为什么如此多的癌症和其他疾病都涉及与TET2相关的突变,并提出了一系列新的治疗靶点。
He说, 这代表了概念上的突破。这不仅为几种疾病的治疗提供了靶点,而且我们正在为生物学中染色质调控的全貌添砖加瓦。我们希望它对现实世界的影响会非常大。
RNA的启示
He实验室有几项发现颠覆了人们对基因如何表达的认识。2011年,他们发现,除了DNA和蛋白的修饰外,RNA的修饰也可能控制基因的表达。
从那时起,He和他的团队发现越来越多的方法表明,RNA甲基化从根本上参与了植物界和动物界基因的开启和关闭。
借助这一视角,他们把目光转向了一个名为 TET2 的基因。长期以来,人们一直知道,当 TET2 或 TET2 相关基因发生突变时,各种问题就会接踵而至。在不同的人类病例中,10%~60% 都会发生这种突变,而其他类型的癌症也会出现这种突变。问题是人们并不知道为何发生这种情况,这大大阻碍了治疗方法的寻找。
TET 家族的其他成员作用于 DNA,因此多年来,科学家们一直在研究 TET2 对 DNA 的影响。但He实验室发现他们找错了地方:TET2 实际上会影响 RNA。
当人类细胞复制自己的遗传物质拷贝时,它们必须被整齐地包装起来并折叠起来,以供日后参考。如果包装不当,各种问题就会接踵而至。事实证明,RNA 是这一过程中的关键角色,它的作用由 TET2 通过一种叫做甲基化的修饰过程来控制。
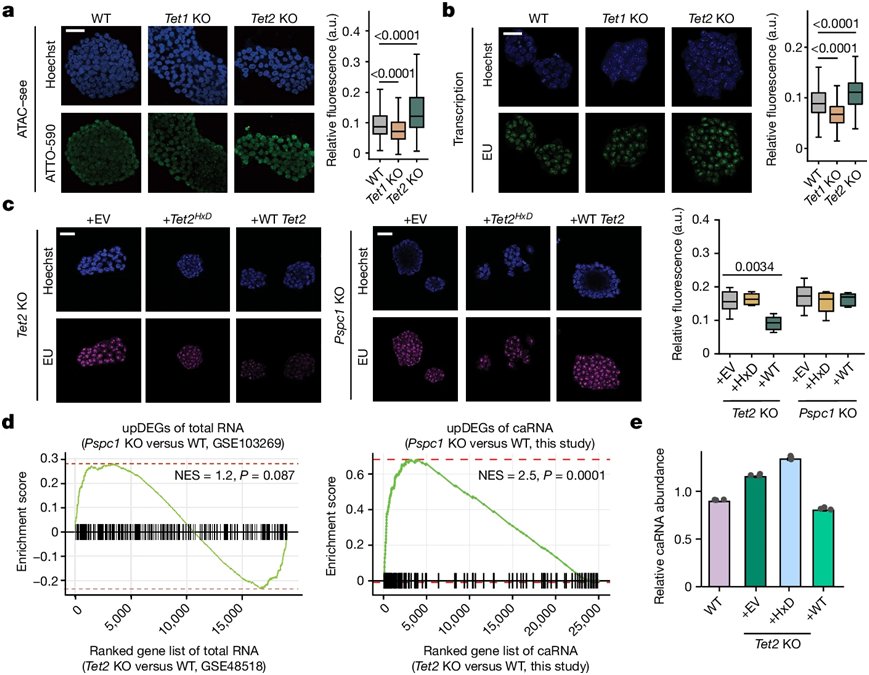
图片来自Nature, 2024, doi:10.1038/s41586-024-07969-x
通过一系列巧妙的实验,移除基因并观察结果,He实验室展示了这一过程是如何进行的。他们发现,TET2控制着一种名为m5C的修饰在某些类型的RNA上发生的频率,而这种修饰会吸引一种名为MBD6的蛋白,进而控制染色质的包装。
当还是婴儿时,人类的细胞正在积极分裂成不同类型的细胞,TET2会放松缰绳,这样染色质就更容易被获取,就能转变成其他细胞。但一旦成年,TET2就应该收紧缰绳。如果失去了这种抑制力,MBD6就会自由行动,大灾难就会接踵而至。
He说, 如果TET2发生突变,就会重新打开这条最终可能导致癌症的生长途径,尤其是在血液和大脑中,因为这条途径看起来在血液和大脑发育中最为重要。
作为最后的确认,He实验室在培养皿中测试了人类白血病细胞。当他们移除细胞生成 MBD6 的能力,即有效地拉紧缰绳时,白血病细胞全部死亡。
灵丹妙药
这一发现最令癌症研究人员兴奋的地方在于,它为他们提供了全新的药物靶点。He说, 我们希望我们能从中得到的启示是通过靶向由于TET2或IDH丢失而激活的特定途径,选择性地除去。
但人们也知道,TET2 突变除了会导致癌症外,还会产生其他后果。在所有 70 岁以上的成年人中,也有一部分人存在 TET2 突变,并导致心脏病、中风、和其他炎症的风险增加,这种情况被称为 CHIP。
芝加哥大学医学院肿瘤学家兼医学助理教授 Caner Saygin 解释说, 这些患者有 TET2 突变血细胞,但尚未引发癌症。但这些TET2突变细胞更具炎症性,随着它们的循环,会导致心脏、肝脏和肾脏等疾病的风险增加。如今,我还不能给这些患者开任何处方,因为他们还没有癌症,但如果我们能消除这些突变细胞,就能改善他们的生活。
显著的变化
这一发现也彻底改变了人们对染色质,进而对整个基因表达的认识。在此之前,人们已知道一种名为 m6A 的 RNA 甲基化形式会影响基因表达,它的加入和移除会影响染色质的包装,而染色质则指导 DNA 的哪些片段发生转录。
但如果 m5C 也属于这一类,那就表明这是一种控制染色质和基因表达的通用机制,而且可能还有更多。He说, 如果有第二种,就可能有第三种、第四种、第五种。这说明染色质上的RNA修饰是染色质和基因转录调控的主要机制。我们认为这条途径只是冰山一角。 (100yiyao.com)
参考资料:
Zhongyu Zou et al. . Nature, 2024, doi:10.1038/s41586-024-07969-x.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Environ Sci Technol:污水处理厂排出的“隐形杀手”——纤维与碎片微塑料成抗生素耐药基因载体,加剧水环境健康风险 (2025-07-10)
- 不抽烟,为什么会得肺癌?Nature:科学家揭秘空气污染如何促进非吸烟人群肺癌的发生 (2025-07-10)
- 江南大学发表最新Cell子刊论文 (2025-07-10)
- 赛多利斯推出 iQue® 5 高通量流式细胞分析仪:快速、灵活、智能,重构高通量筛选体验 (2025-07-09)
- STTT:上中医/北中医团队最新成果证实,天然产物乙酰缬草三酯通过双重铁死亡机制,抑制肠癌的生长、转移和耐药 (2025-07-09)
- Nature系列综述:CAR-T在自身免疫疾病中异军突起,将面临哪些挑战? (2025-07-09)
- Cell Rep Med:癌症诊断新突破!细胞外囊泡“巨无霸”成为液体活检的黄金标记物 (2025-07-09)
- Fertil Steril:定制完美宝宝?基因编辑前夜的抉择——一文读懂PGT-M技术的是与非 (2025-07-09)
- Nat Cancer:科学家破解乳腺癌耐药新机制——γδ T细胞与巨噬细胞的“共谋” (2025-07-09)
- 无需植入支架!血管闭塞患者有了新选择 (2025-07-09)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |
|


















