《蜘蛛侠》跨界科研!蜘蛛丝可以稳定P53 增加抗癌能力 |
 |
来源:100医疗网原创2022-04-03 17336018
前段时间《蜘蛛侠:英雄无归》刷爆了朋友圈,让很多粉丝乐此不疲。
前段时间《蜘蛛侠:英雄无归》刷爆了朋友圈,让很多粉丝乐此不疲。
但是,无论蜘蛛侠是否在漫威漫画的世界里,我们漫长的科研之路总会回到文章。
最近发表在《细胞子杂志结构》上的一篇文章《A "spindle and thread" mechanism unblocks p53 translation by modulating N-terminal disorder》,向我们展示了蜘蛛侠不仅可以拯救地球,还可以与细胞内的肿瘤作斗争,拯救我们的生命。下面,我们就来仔细分解一下蜘蛛侠如何联合命名一个跨界研究圈!

从题目中,我们可以看到曾经大名鼎鼎的P53基因。在近几年大热的PD1/PDL1兴起之前,说到肿瘤基因,P53绝对是第一热词(15年前,我还不知道P53基因的时候,都不好意思说我是研究癌症的)。P53基因是控制细胞增殖的关键基因,在多达60%的人类癌症中可以发现P53突变和失活。因此,如何恢复P53基因的正常功能已成为癌症治疗的有效策略。从这个角度出发,本文在这个经典分子上做文章。
以前的研究集中在如何校正P53基因的DNA结合域以稳定细胞中的P53基因。然而,在本文中,作者创新性地使用融合蛋白的思想,通过融合强伴侣蛋白来稳定p53蛋白免于降解。基于这样的想法,作者最终将目光投向了蜘蛛侠著名的特技蜘蛛丝蛋白。蜘蛛丝蛋白具有高度保守的N-末端结构域,并且非常容易聚集而不降解。这些特征使作者考虑是否可以通过这些特征稳定P53蛋白而不降解。
因此,本文作者利用蜘蛛丝蛋白结构域的这一特性,融合表达P53蛋白,从而产生一种稳定表达的具有生物活性的蜘蛛丝-P53蛋白突变体。这种稳定的蛋白质策略有望用于开辟新的药物和结构生物学研究。
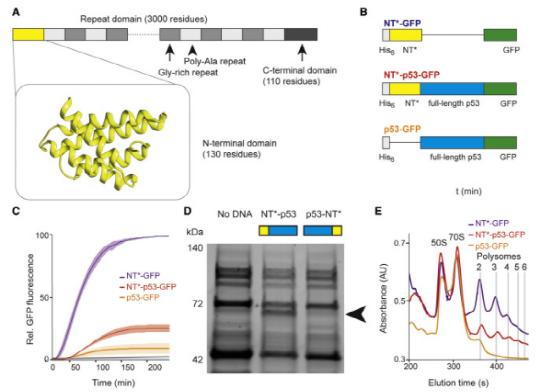
图一。NT增加p53的翻译效率
翻译水平是蛋白质表达的直接表现,所以作者首先评估了蛛丝蛋白结构域对P53基因翻译的影响。融合表达蜘蛛丝蛋白结构域、全长p53和GFP,通过检测GFP荧光强度的变化表征P53转录和翻译水平的变化。该方法能真实反映蜘蛛丝-p53融合蛋白的翻译效率。结果发现仅连接在p53末端的蜘蛛丝蛋白结构域能提高p53的体外翻译水平。此外,比较了P53-GFP和蜘蛛丝-P53-GFP蛋白表达之间核糖体活性的差异,证实了蜘蛛丝蛋白的融合表达可以提高P53的翻译水平。
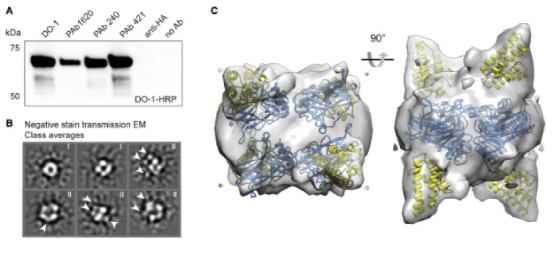
图2。nt-p53融合蛋白的结构
蜘蛛丝-p53融合表达的高产量使作者进一步思考融合蛋白如何影响p53原有的蛋白结构。因此,作者纯化了蜘蛛丝-P53融合蛋白,并对其蛋白结构进行了分析。通过戊二醛交联蛋白和Western Blot实验,发现蜘蛛丝蛋白结构域的存在不具有原始p53蛋白的结构构象和寡聚形式。此外,尽管过去对P53蛋白折叠的核心结构域进行了许多研究,但其反式激活结构域的方向一直难以确定。因此,作者推测额外的蜘蛛丝标签可以帮助我们了解p53蛋白反式激活域的方向。用投影电镜确定蜘蛛丝-p53融合蛋白中蜘蛛丝标记的方向。发现蜘蛛丝蛋白结构域与p53蛋白的四个DNA结合结构域密切相关,p53的N-末端区域不在其中延伸。
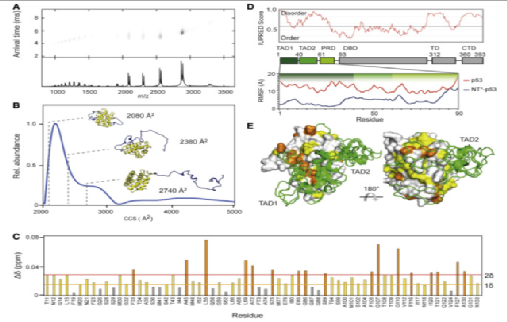
图3。NT诱导p53 TADs的压缩
因为投影电镜无法分析p53蛋白结构中的无序区域。因此,作者转向离子迁移质谱(IM-MS)来评估融合蛋白中反式激活结构域1和2的整体构象。结果表明,蛋白质在上述区域是松散的。此外,核磁共振的结构分析表明,蜘蛛丝蛋白的融合并没有改善p53蛋白结构中反式激活结构域的紊乱。同时,结合p53蛋白序列中前90个氨基酸序列的全原子分子动力学(MD)模拟,作者确定蜘蛛丝蛋白结构域在p53融合蛋白中保持折叠,并诱导融合蛋白的紧密构象,其中p53 N端的反式激活区包裹在蜘蛛丝蛋白周围。
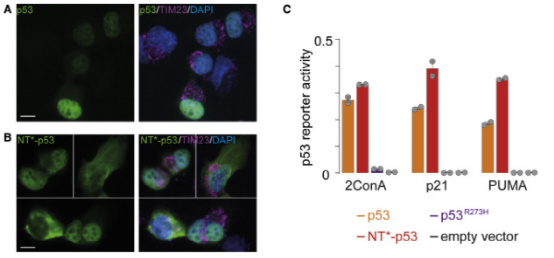
图4。NT -p53在1299细胞中有活性
在充分分析蜘蛛丝-p53融合蛋白的结构后,作者探索了它在H1299癌细胞中是否具有稳定的活性,因此它可以作为一种潜在的癌症治疗方法。转染后,通过组织化学,作者发现融合蛋白没有聚集在细胞质中,而是像野生型P53蛋白一样进入细胞核。同时,荧光素酶报告实验证明该融合蛋白对p53基因转录因子的活性没有影响。
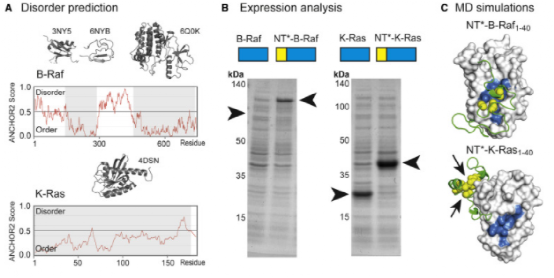
图5。theNT策略在B-Raf和K-Ras中的应用
最后,作者通过两个原癌基因蛋白B-raf和K-Ras验证了蜘蛛丝蛋白结构域增加p53翻译水平和减少N端无限结构的关系。结果表明,蜘蛛丝蛋白结构域能促进B-raf的表达,但不影响K-Ras的表达。此外,分子动力学模拟揭示了上述现象的结构机制。
在细胞中创造更稳定的p53变体是一种有前途的癌症治疗方法,现在我们有了一种值得探索的工具。卡罗林斯卡学院高级教授大卫莱恩表示,我们最终希望开发出一种基于mRNA的癌症疫苗,但在此之前,我们需要知道这种蛋白质在细胞中是如何处理的,以及大量的蛋白质是否有毒。
参考资料:
[1] Kaldm e M,et al.“纺锤体和线”机制通过调节N-末端紊乱解除p53翻译的阻断。结构。2022年3月10:S0969-2126(22)00049-1。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享。请扫描二维码下载-


- 相关报道
-
- Nature Methods :“垃圾”数据里掘金!流式细胞术迎来革命,解锁百万细胞互作的秘密语言 (2025-08-10)
- Immunity:黄波团队利用生物机械力信号强势扩增干性 CAR-T 细胞,有望颠覆实体肿瘤细胞治疗 (2025-08-10)
- Nature Genetics:大脑里的“冰与火之歌”——揭秘抑郁症中“过热”的神经元与“沉睡”的免疫哨兵 (2025-08-10)
- 《自然·免疫学》:华人科学家首次发现,肿瘤利用激素SCG2调节髓系细胞免疫抑制功能! (2025-08-10)
- Cell:沈西凌团队揭开癌症患者暴瘦的原因,并提出治疗方法 (2025-08-10)
- 今年第5篇Cell、Nature、Science正刊!姜长涛团队最新Cell论文,利用AI工具,挖掘出超60万种胆汁酸代谢酶 (2025-08-09)
- iScience:惊!夜间喝咖啡竟会增加冲动行为,尤其是女性 (2025-08-08)
- 事关脑机接口家当立异倒退 七部分宣布重磅文件 (2025-08-08)
- PD-(L)1/VEGF之后,双抗BD的新王牌藏在哪? (2025-08-08)
- 辉瑞2025H1:ADC产品销售收入15亿美元,还有130亿美元BD弹药 (2025-08-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















