《自然·神经科学》:贝勒医学院团队发现tau蛋白磷酸化和聚集的新机制! |
 |
来源:奇点糕 2024-11-23 11:03
2023年,美国贝勒医学院Huda Yahya Zoghbi 团队就在《神经元》上发文,他们通过跨物种遗传筛选,发现酪氨酸激酶2(TYK2)可能是一个调节tau蛋白水平的重要因子,但至于2023年,美国贝勒医学院Huda Yahya Zoghbi 团队就在《神经元》上发文,他们通过跨物种遗传筛选,发现酪氨酸激酶2(TYK2)可能是一个调节tau蛋白水平的重要因子,但至于TYK2是如何调节tau蛋白水平的,还不清楚。
近期,Huda Yahya Zoghbi 团队再次发文,进一步验证了,TYK2之所以是一个调节tau蛋白水平的重要因子,是因为TYK2可通过磷酸化tau蛋白的酪氨酸残基(Tyr29),来影响tau蛋白的稳定和聚集。
具体来说,这种磷酸化增加了tau蛋白的稳定性,使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集。而在tau病理小鼠模型中,研究人员发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症。
研究发表在《自然 神经科学》上[1]。

论文首页截图
通过在人类细胞系和小鼠大脑中减少Tyk2的表达,研究人员观察到,随着Tyk2表达的减少,tau蛋白的浓度也随之降低。这也意味着,TYK2确实能够调节tau蛋白水平。
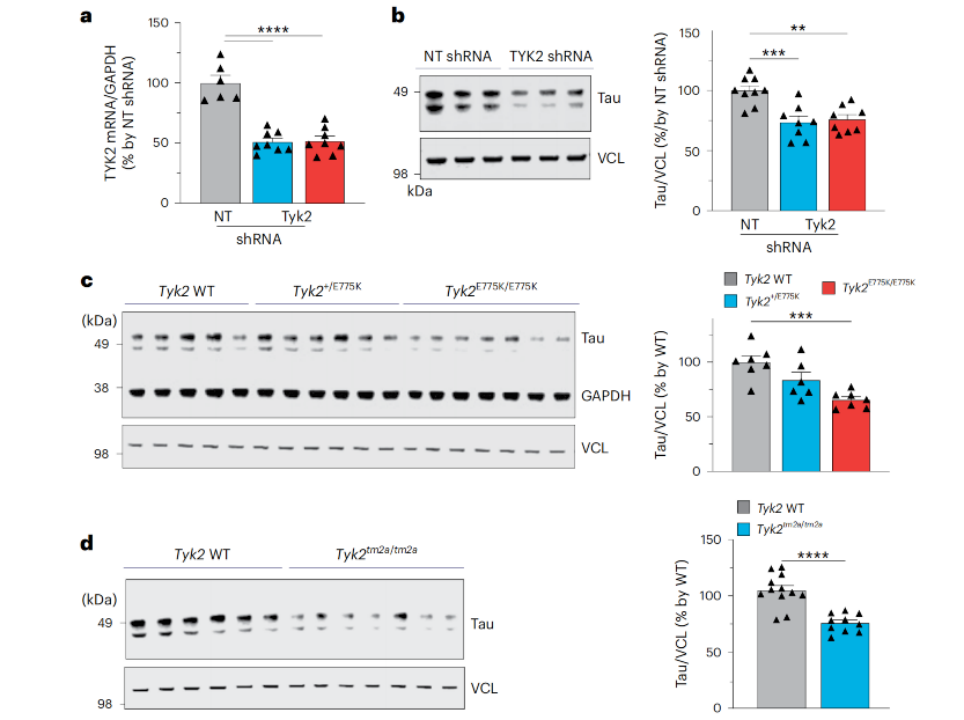
TYK2调节tau蛋白水平
进一步的共沉实验结果显示,TYK2与tau蛋白存在相互作用。鉴于TYK2是一种酪氨酸激酶,可以在底物蛋白上磷酸化酪氨酸残基,因此,研究人员猜想,TYK2与tau蛋白结合位点可能在酪氨酸残基上,并以此来实现对tau蛋白的磷酸化。
为了验证这一猜想,研究人员进行了体外细胞激酶实验和免疫印迹分析。结果也证实,在TYK2存在的情况下,tau蛋白的酪氨酸残基确实被磷酸化了。
根据既往研究,tau蛋白共有5个可以被磷酸化的酪氨酸残基,分别是Tyr18、Tyr29、Tyr197、Tyr310和Tyr394。为了找到究竟哪个残基被TYK2特异性磷酸化了,研究人员分别用苯丙氨酸取代了tau蛋白的每个酪氨酸残基,然后再进行体外激酶实验,检测TYK2的磷酸化作用。
结果发现,只有Tyr29残基被苯丙氨酸取代的时候,TYK2介导的磷酸化才会消失。这也意味着Tyr29是TYK2磷酸化tau蛋白的关键位点。
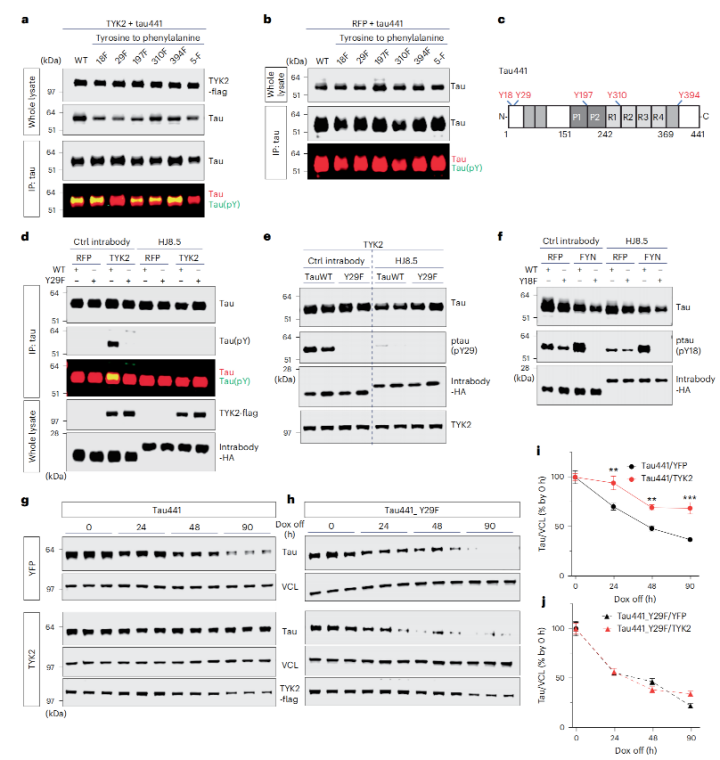
TYK2与tau蛋白结合,并特异性磷酸化了tau蛋白的Tyr29
接下来,研究人员探讨了TYK2介导的tau磷酸化在tau病理中的作用。结果发现,TYK2介导的磷酸化增加了tau蛋白的稳定性,并使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集(具体表现为在TYK2存在的情况下,tau蛋白的周转率,也就是tau蛋白在细胞内被降解的速度变慢了,而敲低Tyk2能够改善这一现象,尤其是在Tyr29被苯丙氨酸取代后,TYK2介导的磷酸化完全消失)。
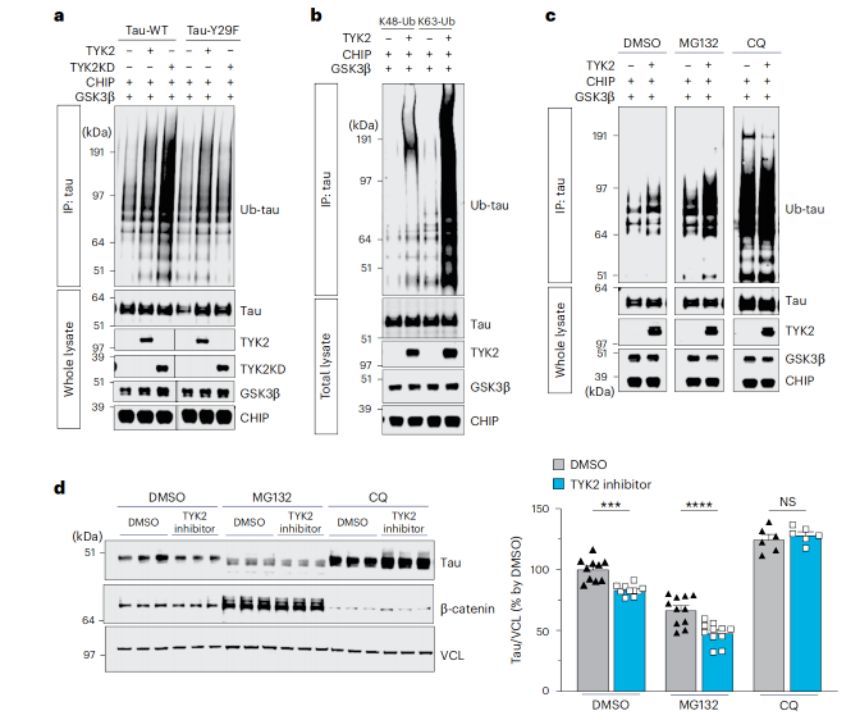
TYK2介导的磷酸化阻碍了tau蛋白通过自噬途径降解
进一步,研究人员还在tau病理小鼠模型中探讨了TYK2的作用。通过构建含有TYK2激酶域(TYK2KD)的P301S tau小鼠,研究人员再次证实,这种激酶可以通过磷酸化tau蛋白的Tyr29,引发小鼠脑内病理性tau蛋白的大量积累(而当Tyr29被苯丙氨酸取代后,这一现象就会消失)。
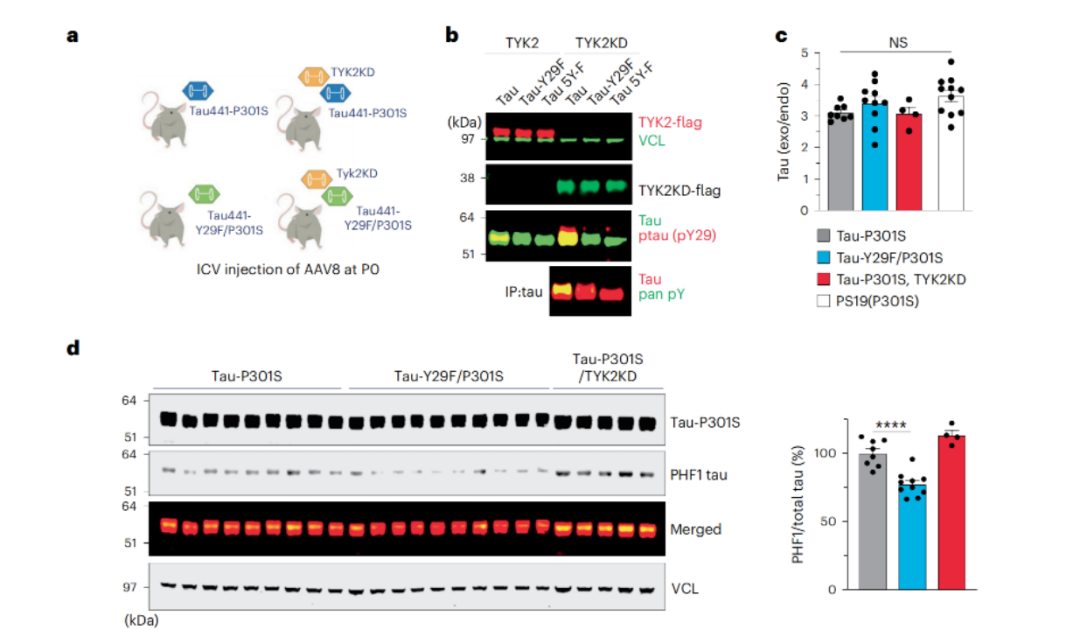
TYK2介导的磷酸化引发小鼠脑内病理性tau蛋白的大量积累
相反,当研究人员构建Tyk2敲低的PS19 tau小鼠模型后发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症(如小胶质细胞增生减少)。
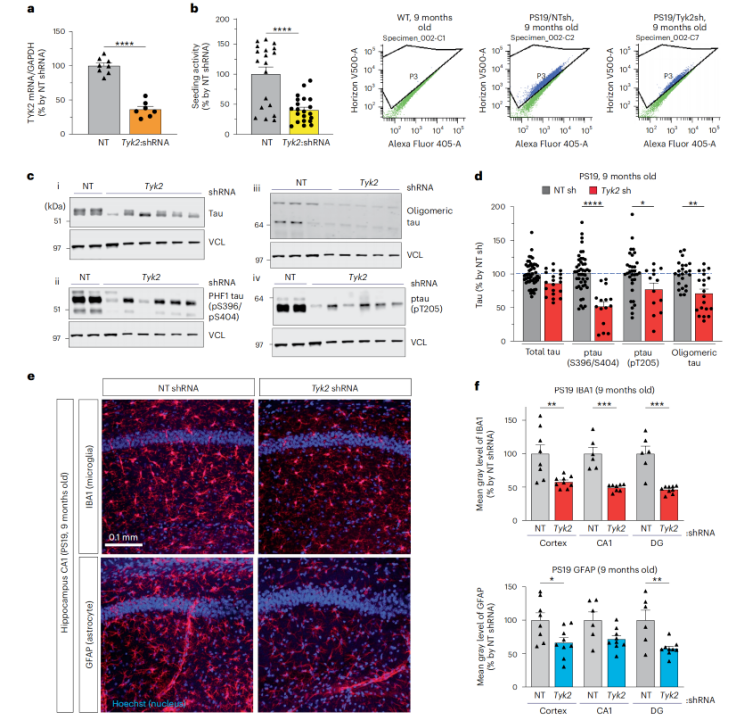
敲低Tyk2后,总tau和致病性tau蛋白的水平下降
综上,该研究首次证实,TYK2可通过磷酸化tau蛋白的Tyr29残基,来影响tau蛋白的稳定和聚集。这一发现不仅揭示了tau蛋白异常聚集的新机制,也为tau蛋白病的治疗提供了新的靶点。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 业内子士山西太原聚焦生物医药行业牌号品牌维护 (2025-09-08)
- Nature:Cas9的“B面人生”——从基因剪刀到免疫记忆的调速器 (2025-09-08)
- 清华×北大合作发表Cell子刊论文:揭开口腔病毒与肥胖和糖尿病的关联 (2025-09-08)
- 《细胞·代谢》:中国人民解放军第四军医大学团队发现,限制含硫氨基酸摄入或可改善自闭症相关社交障碍! (2025-09-07)
- 干细胞抗抑郁!中国科学院×复旦大学合作论文登上Cell Stem Cell封面 (2025-09-07)
- Nature Genetics:为中心粒划界——DNA甲基化对中心粒定位与基因组完整性的双重调控 (2025-09-07)
- Nature:邓彦翔/周畹町团队将空间多组学技术扩展至DNA甲基化领域 (2025-09-07)
- 北京大学最新Cell子刊:激活肿瘤细胞焦亡,提高抗肿瘤免疫效果 (2025-09-06)
- Nature:突破罕见病治疗困境!科学家发现巴氏综合征的新型治疗靶点 (2025-09-06)
- Cell子刊:天津医科大学李祥春/陈可欣团队开发AI大模型,对原发灶不明癌症进行分类和定位 (2025-09-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















